2. 广西科学院,广西南宁 530007
2. Guangxi Academy of Sciences, Nanning, Guangxi, 530007, China
【研究意义】脂肪酶(Lipase, EC 3.1.1.3)是一类典型的羧酸水解酶,在油水界面处发挥催化活性,将甘油酯水解为甘油和游离脂肪酸,是重要工业生物技术用酶之一。绝大多数脂肪酶来源于微生物,不同微生物产生的脂肪酶酶学性质(包括底物选择性、最适温度及温度耐受性、最适pH值及pH耐受性、有机溶剂耐受性、金属离子等激活或抑制效果等)往往存在差异[1]。这些酶学性质决定了该种脂肪酶是否具有广泛的生物催化应用性。脂肪酶催化是绿色催化的重要组成部分。从自然界筛选分离到的野生型脂肪酶菌株产酶较低,因此,克隆其脂肪酶基因,构建高效脂肪酶基因工程菌,获得自主生产的脂肪酶酶源或全新的脂肪酶催化剂,是推广脂肪酶催化应用的有效措施。【前人研究进展】国内对微生物脂肪酶的研究与开发较晚,有关产脂肪酶基因工程菌的研究报道甚少。本实验室前期构建的基因工程菌株在IPTG诱导下可实现目的蛋白的可溶性表达,但表达量较低,且大部分目的蛋白以包涵体形式存在。自动诱导是一种基于分解代谢阻遏效应原理的诱导方法,即当培养基中同时存在葡萄糖和乳糖时,大肠杆菌优先利用葡萄糖(速效碳源),当葡萄糖耗完后才开始利用乳糖(迟效碳源),通常能观察到菌体的二次生长现象[2-3]。该方法是Studier[2]于2005年提出的一种获取高产蛋白及高密度细胞的诱导方法,主要针对含T7lac启动子的pET表达系统,解决传统方法中重组菌外源蛋白本底水平表达所产生的不利影响的等问题;尤其是在利用重组菌表达一些毒性蛋白时,本底表达对宿主菌生长是致死的。目前,该方法在许多于大肠杆菌中表达的外源蛋白的研究中得到广泛应用,同时其简便的操作、高效的表达和高菌体密度的优点也被不断证实。如Nie等[3]利用自动诱导培养基培养BL21(DE3)/pET-22b(+)-pul重组菌株,最终收获的发酵液中普鲁兰酶的总酶活高达580 U/mL,是IPTG诱导方法获得的总酶活力的41.2倍,并通过优化添加剂甘氨酸的浓度,使胞外酶活达到502 U/mL;Rad-Malekshahi等[4]为获得SA2基因在大肠杆菌的高效表达,采用了自动诱导培养基进行诱导表达,与IPTG诱导相比较,菌体密度和蛋白表达量分别提高了3.5倍和4倍;EL-Baky等[5]采用自动诱导培养基并结合诱导温度优化诱导达量胞外cIFN-α蛋白的表达,胞外蛋白占细胞裂解液总蛋白的70%,经DEAE-Sepharose层析柱单步分离纯化后,蛋白产量达270 mg/L,远远高于文献报道的数值。【本研究切入点】虽然基因工程技术使得脂肪酶的异源表达研究取得了一些成绩,但对于整合型脂肪酶重组菌的自动诱导发酵表达,目前国内鲜有报道。【拟解决的关键问题】本研究以整合型脂肪酶重组菌为研究对象,优化自动诱导发酵培养基碳源组分,使蛋白表达量增加的同时,提高单位菌体蛋白产量,探索高效表达可溶蛋白的工艺条件。
1 材料与方法 1.1 菌种本实验室利用Tn7启动子构建了一株转座子整合型的脂肪酶重组菌株。
1.2 培养基LB培养基:蛋白胨10 g/L,酵母粉5 g/L,NaCl 5 g/L,pH值为7.0。
TYM-5052培养基:蛋白胨10 g/L,酵母粉5 g/L,甘油5 g/L,葡萄糖0.5 g/L(过滤除菌),乳糖2 g/L(过滤除菌),Na2HPO4·12H2O 17.9 g/L,KHPO4 6.8 g/L,NH4Cl 2.675 g/L,Na2SO4 0.71 g/L,MgSO4·7H2O 0.5 g/L(单独灭菌)。
说明:TY为蛋白胨和酵母粉的英文首字母简写;M代表自动诱导培养基中的盐离子成分;5052为自动诱导培养基中的甘油、葡萄糖和乳糖的百分比浓度组合简写,即甘油5 g/L,葡萄糖0.5 g/L,乳糖2 g/L。
1.3 种子培养将活化后的菌种接种至种子培养基于28℃、220 r/min培养至对数期。
1.4 摇瓶发酵按1%的接种量将种子液接种至装有50 mL发酵培养基的250 mL三角瓶中,28℃、220 r/min培养48 h。测定菌体浓度OD600。发酵液经10 000 r/min离心5 min,收集菌体,重悬后超声破碎,取上清液测酶活性。
1.5 响应面设计优化自动诱导发酵培养基采用3因素3水平的CCD响应面设计方法,选择甘油浓度、葡萄糖浓度、乳糖浓度这3个对自动诱导发酵影响较大的碳源因素进行响应面实验设计,以脂肪酶的比活力为优化指标,并进行3次重复实验。对于3因素3水平的中心组合实验共需要17次实验。拟合出一个二次多项式方程。该方程为描述响应变量(因变量)与自变量的经验模型。实验设计、数据分析及模型建立主要采用统计分析软件Design Expert 7.0来完成。
1.6 验证试验利用优化后的发酵培养基配方进行脂肪酶重组菌的发酵试验,重复3次。以初始发酵培养基作为对照。
1.7 脂肪酶酶活测定酶活定义:在40℃和pH值为6.0条件下,1 min内催化对硝基苯棕榈酸酯生成l μmol对硝基苯酚(p-NP)所需要的酶量为1个酶活单位(U)。
以对硝基苯棕榈酸酯(p-NPP)为底物,利用多功能酶标仪在96孔板上测定脂肪酶的活性。加入50 μL酶液到400 μL 0.05 mmol/L磷酸缓冲液(pH值为6.0)中,40℃保温,预热5 min,加入50 μL 10 mmol/L p-NPP异丙醇溶液反应5 min后,加入500 μL 10%三氯乙酸终止反应,在加入1 mL 1 mol/L Na2CO3,取200 μL反应液测定在405 nm的OD值。
2 结果与分析 2.1 自动诱导发酵培养基碳源成分优化自动诱导发酵培养方法中,乳糖既作为碳源,用于菌体生长及维持机能,又作为诱导剂,诱发蛋白表达。葡萄糖作为一种快速利用碳源,对于菌体快速生长至对数期,起着重要的作用,同时葡萄糖又抑制乳糖的诱导,影响蛋白的表达。甘油是常用的一种碳源,在自动诱导发酵过程中,弥补乳糖利用不足于菌体的生长需要。三者有着至关重要的作用。如何调整乳糖、葡萄糖和甘油的浓度,使之在自动诱导发酵过程,兼顾菌体生长量,又保证蛋白的表达。采用TYM-5052培养基为基础培养基,通过改变甘油浓度、葡萄糖浓度、乳糖浓度,探究这3个因素对脂肪酶重组菌自动诱导发酵产酶的影响。
2.1.1 甘油浓度优化保持培养基中其他成分浓度不变,改变培养基中的甘油浓度,探究重组菌表达脂肪酶基因所需的最适甘油浓度。图 1结果表明,甘油浓度在5~100 g/L之间时,菌体密度随着甘油浓度增加而增加;甘油浓度在5~40 g/L范围内时,脂肪酶活力呈明显上升趋势,说明适当提高培养基中的甘油浓度有利于重组菌的菌体密度和酶活力的提高;当甘油含量为40 g/L时,酶活达到最大值84.6 U/mL,比活力达到最大值6.42 U/mg,较初始培养基提高了约1倍。

|
图 1 甘油浓度对脂肪酶表达量的影响 Fig.1 Effect of glycerol at different concentrations on yield of lipase |
图 2显示,随着培养基中的葡萄糖含量增加,脂肪酶表达的酶活呈下降趋势,葡萄糖浓度越高,菌体密度越大,蛋白表达越低。可能是在快速利用碳源——葡萄糖存在条件下,菌体生长速率快,乳糖来不及诱发蛋白表达而导致蛋白表达率低。

|
图 2 葡萄糖浓度对脂肪酶表达量的影响 Fig.2 Effect of glucose at different concentrations on yield of lipase |
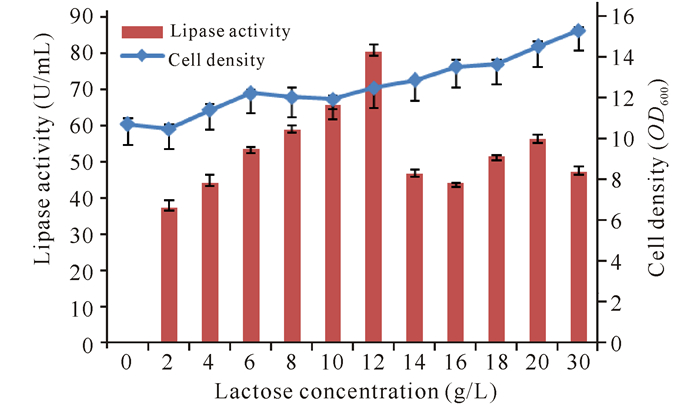
图 3显示,适当地提高培养基中的乳糖含量,有利于重组菌的菌体密度和脂肪酶基因表达量的提高。当乳糖浓度为12 g/L时,酶活最高达80 U/mL,比活力值最高,为6.42 U/mg,是初始培养基中脂肪酶比活力的1.8倍。
|
图 3 乳糖浓度对脂肪酶酶表达量的影响 Fig.3 Effect of lactose at different concentrations on yield of lipase |
在单因素优化实验结果的基础上,利用响应面中心组合设计方法对培养基中的碳源如甘油、葡萄糖和乳糖浓度作进一步优化。实验结果及RSM法预测的结果见表 1。
| 表 1 中心组合实验设计方案及实验结果 Table 1 Coded values and corresponding real values of the fermentation conditions tested in CCD experimental design |
利用Design Expert软件对表 1的试验结果进行回归拟合,建立二次响应面回归模型,3个因素对发酵液脂肪酶比活力的影响可用回归方程式表示为
| $ \begin{array}{l} {R_1} = - 2.495 + 0.3{X_1} + 0.709{X_2} + 0.564{X_3} - \\ 0.065{X_1}{X_2} - 0.007{X_1}{X_3} - 0.045{X_2}{X_3} - 0.004X_1^2\\ - 6.857X_2^2 - 0.014X_3^2 \end{array} $ |
为了检验回归模型的显著性,利用方差分析进行了F检验,其结果见表 2。由方差分析结果可知,自变量一次项X2、X3,二次项X1X3、X12、X22、X32显著(P < 0.05),说明拟合的二次回归方程合适。回归模型的失拟项为Lack of Fit值为0.91,即方程模型失拟不显著,并且该方程的决定系数为R2=0.886 4(>0.80),表明该方程回归程度良好。Adeq Precision值为6.593(>4),即该模型可用于预测。
| 表 2 方差分析表 Table 2 ANOVA analysis of coefficient of the regression equation |
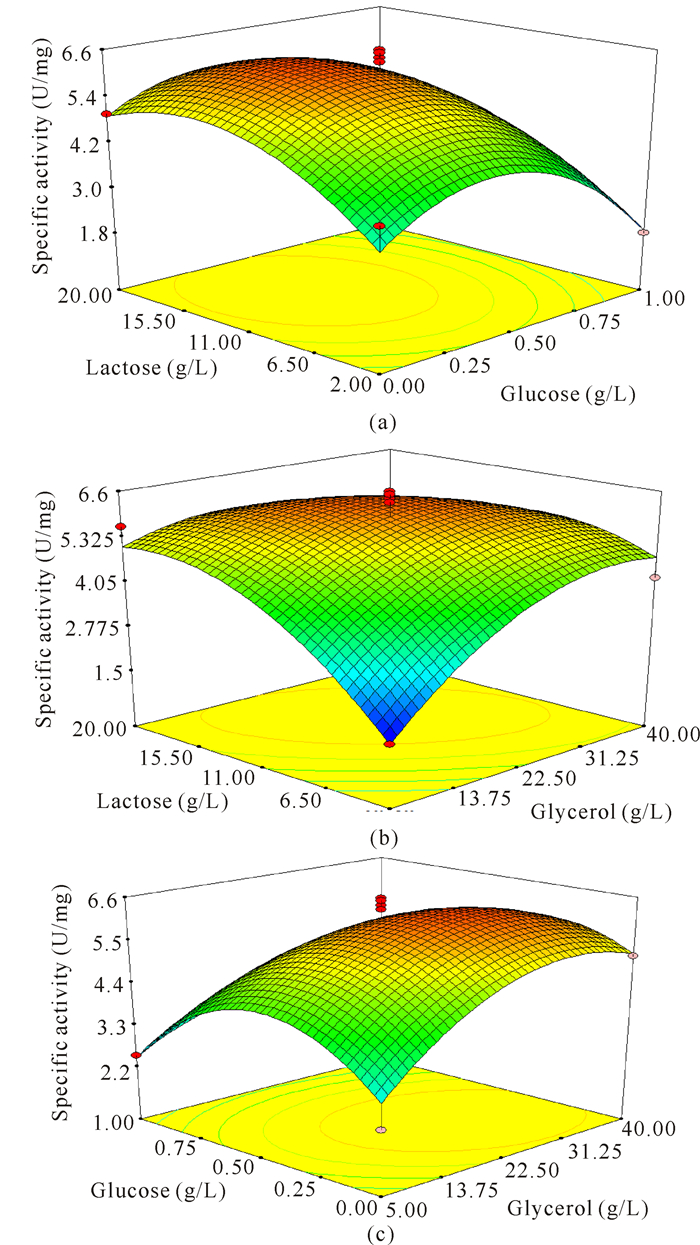
表面响应图能够预测检测变量的响应值和确定变量相互作用的形式。若图 4a、4c为圆形等高线,说明glycerol与glucose、glucose与lactose变量间的相互作用可忽略;图 4b为椭圆,则glycerol与lactose变量间的相互作用对脂肪酶自动诱导发酵时的比活力的影响是非常明显的。
|
图 4 响应面立体分析图和相应的等高线图(a:X2,X3;b:X1,X2;c:X1,X3) Fig.4 Three dimensional surface and contour patterns using response surface method (a:X2, X3; b:X1, X2; c:X1, X3) |
利用Design Expert软件对获得的非线性二次回归模型及响应面进行自动诱导发酵,由图可知,在X1、X2、X3分别为25.98 g/L、0.35 g/L、12.89 g/L时,R1具有最大值6.287 U/mg。也即脂肪酶自动诱导发酵液中比活力最高时的培养基组成(W/V)为glycerol 2.596,glucose 0.035,lactose 1.289,tryptone 1.0,yeast extract 0.5,Na2HPO4·12H2O 1.79,KH2PO4 0.68,NH4Cl 0.267 5,Na2SO40.071,MgSO4·7H2O 0.05。结果与对图 4的直观分析相吻合,其预测的响应值为R1= 6.287 U/mg。
2.2 优化结果验证为验证二次回归模型的准确性和有效性,根据最优碳源培养基配方对回归模型进行50 L发酵罐验证试验。结果表明,最优碳源培养基的比活力为R1=6.35 U/mg,与模型预测值R1=6.287 U/mg很接近;而初始发酵培养基的比活力为R1=1.55 U/mg。结果证实利用CCD响应面实验设计法来优化自动诱导发酵培养基的碳源是可行的、有效的,具有实用价值。
3 讨论通过对自动诱导发酵培养基中的碳源进行优化发现,甘油对菌体的生长影响比较大,而葡萄糖则对脂肪酶的表达影响比较大,随着葡萄糖浓度的增加,蛋白表达量持续降低。乳糖在自动诱导表达系统中,在速效碳源利用完后,既作为碳源又作为诱导剂,即使在没有速效碳源的情况下,蛋白的表达量也不好受到很大的影响。随着乳糖浓度的增加,蛋白表达量也在不断的增加,当达到一定量后,再增加乳糖的含量也不能改变蛋白表达量。
本实验中自动诱导发酵培养基的甘油、葡萄糖、乳糖三种碳源,甘油和乳糖之间的相互作用对脂肪酶自动诱导表达时的比活力的影响是非常明显的。通过调整三者的浓度关系,可以提高脂肪酶的可溶性表达。这与龚志飞等[6]及Blommel等[7]的研究结果相类似。本实验中只对自动诱导表达的分批发酵工艺进行了初步探索,为了获得更多的蛋白表达,还需进一步完善分批发酵工艺条件,并深入研究自动诱导表达的分批补料发酵工艺,这样才能使自动诱导表达方法应用于工业生产中,对生物产业发挥更大的作用。
4 结论本研究结果表明,优化后的自动诱导培养基对整合型脂肪酶重组菌的蛋白表达有显著的提高,但微生物发酵复杂多化,不同发酵工艺之间的蛋白表达结果相差较大,相对于毕赤酵母系统和IPTG诱导表达系统具有很大的优势,但是目前自动诱导表达不能在工业生产上应用,因此,在培养基优化的基础上,有待于继续探索更优化的自动诱导表达发酵工艺,使之适用于工业化生产。
| [1] |
BAJAJ A, LOHAN P, JHA P N, et al. Biodiesel production through lipase catalyzed transesterification:An overview[J]. Journal of Molecular Catalysis B:Enzymatic, 2010, 62(1): 9-14. DOI:10.1016/j.molcatb.2009.09.018 |
| [2] |
STUDIER F W. Protein production by auto-induction in high-density shaking cultures[J]. Protein Expr Purif, 2005, 41(1): 207-234. DOI:10.1016/j.pep.2005.01.016 |
| [3] |
NIE Y, YAN W, XU Y, et al. High-level expression of bacillus naganoensis pullulanase from recombinant Escherichia coli with auto-induction:effect of lac operator[J]. PlOS ONE, 2013, 10(8): e78416. |
| [4] |
RAD-MALEKSHAHI M, FLEMENT M, HENNINK W E, et al. Optimization of the recombinant production and purification of a self-assembling peptide in Escherichia coli[J]. Microbial Cell Factories, 2014, 13(1): 1-8. DOI:10.1186/1475-2859-13-1 |
| [5] |
EL-BAKY N A, LINJAWI M H, REDWAN E M. Auto-induction expression of human consensus interferon-alpha in Escherichia coli[J]. BMC Biotechnology, 2015, 15(1): 14. DOI:10.1186/s12896-015-0128-x |
| [6] |
龚志飞, 杨翔, 颜法宝, 等. 重组人抗血栓蛋白在大肠杆菌中的自动诱导表达及纯化[J]. 生物技术通报, 2011, 12: 192-198. GONG Z F, YANG X, YAN F B, et al. Auto-inducting expression and purification of recombinant human anticoagulant protein in Escherichia coli[J]. Biotechnology Bulletin, 2011, 12: 192-198. |
| [7] |
BLOMMEL P G, BECKER K J, DUNVJAK P. Enhanced bacterial protein expression during auto-induction obtained by alteration of lac repressor dosage and medium composition[J]. Biotechnology Progress, 2007, 23(3): 585-598. |
 2018, Vol. 25
2018, Vol. 25 


