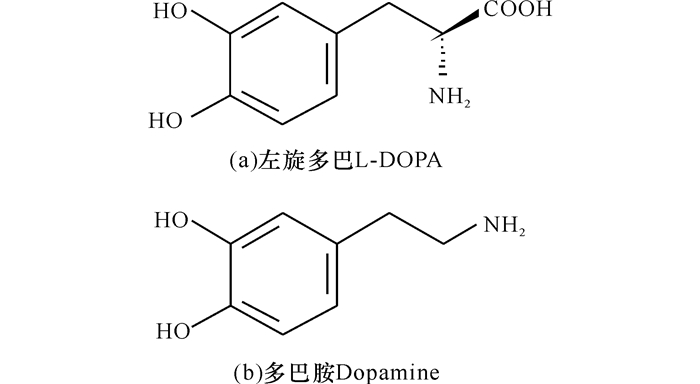
左旋多巴(L-DOPA)化学名为β-3, 4-二羟苯基-α-丙氨酸(3, 4-2dihydroxylphenylalanine)(图 1a),为白色结晶性粉末,无臭无味,不溶于乙醇、氯仿和丙酮,易溶于稀酸。左旋多巴能通过血脑屏障,到达中枢神经系统,并在脱羧酶的作用下转变为多巴胺(图 1b),进而发挥治疗帕金森综合症(Parkinson's disease)的作用[1]。
|
图 1 左旋多巴和多巴胺的分子结构 Fig.1 The molecular structural of L-DOPA and dopamine |
左旋多巴于1970年被美国食品药品监督管理局批准为治疗帕金森综合症的药物[2]。据统计,普通人群帕金森病的发病率为0.1%,60岁以上老人的发病率为1%,80岁以上的发病率为2%[3-4]。随着世界各国人口老龄化的加剧,国内外对左旋多巴的市场需求强劲[5]。帕金森病药物市场将会从2014年的21亿美元增长到2021年的32亿美元,4款新的左旋多巴制剂有望在2021年前进入市场,具有广阔的市场前景[6]。目前L-DOPA的制备方法有化学合成、植物提取、酶催化、微生物发酵法。化学合成法具有过程工艺繁杂、产物的转化效率较低、成本高、环境污染的问题。植物提取由于受到原料来源的限制,并且提取产量小,远不能满足市场需求。酶催化法由于催化时间长,成本高。微生物发酵具有污染少、产品质量高等优点,极具发展前景。笔者所在课题组在前期构建的高产3-脱氢莽草酸(DHS)的基础上,创新关键酶催化和生化反应,通过优化左旋多巴生物合成途径中关键基因aroE、tyrA、hpaBC的调控,构建出高效发酵生产左旋多巴的微生物细胞工厂。该工程菌具有发酵培养基简单、发酵控制工艺易操作、发酵产物产量稳定等特点。本文重点针对左旋多巴微生物代谢工程的研究进行评述,并对左旋多巴生物合成的研究方向进行展望。
1 化学合成左旋多巴目前工业化生产主要以香草醛和乙内酰脲为原料,以不对称合成法经过8步的化学反应制得。由于化学合成过程中需要高温高压、大量的金属催化剂,工艺复杂,并且产物的转化率和旋光性均较低,同时还存在成本高、环境三废污染等问题[7],所以开发新的合成方法是今后的重点和方向。
2 植物提取左旋多巴天然植物如猫豆、藜豆中都存在左旋多巴[8],其中猫豆中的含量达到6%~9%,是提取左旋多巴主要的原料。通过改进提取方法,猫豆中左旋多巴的提取得率从1.5%提高到3.4%,纯度达到99.9%[9]。虽然从猫豆中提取左旋多巴是一种有效的方法,但该方法受到原料来源少、产量小的限制,导致生产成本较高,难以大规模生产,无法满足市场需求。
3 生物酶催化合成左旋多巴酶催化合成是用特定的酶在一定的条件下通过底物转化生成左旋多巴。目前有3种酶可以催化左旋多巴的生成[10]:①酪氨酸酶(tyrosinase),该酶以酪氨酸为底物;②酪氨酸酚解酶(tyrosine phenollyase,TPL),该酶以邻苯二酚、氨水以及丙酮酸为底物;③转氨酶(transaminase),该酶将天冬氨酸或谷氨酸上的氨基转移至3, 4-二羟基苯丙酮酸上,催化反应生成左旋多巴。
3.1 酪氨酸酶法合成法酪氨酸酶(tyrosinase)以酪氨酸作为底物,催化合成左旋多巴。Krishnaveni等[11]利用Acremonium rutilum具有较高的酪氨酸酶生产能力的特性,转化酪氨酸合成左旋多巴。该菌在经过优化的培养条件下连续培养120 h,左旋多巴的最大产量为0.89 g/L。
3.2 酪氨酸酚解酶合成法酪氨酸酚解酶(TPL)可催化邻苯二酚、丙酮酸和氨水生成左旋多巴,催化反应过程中需要磷酸吡哆醛(胺)为辅酶、钾离子和氨离子为辅因子[12]。Lee等[13]用来源于Symbiobacterium sp.SC-1的酪氨酸酚解酶(TPL),将儿茶酸、丙酮酸和氨转化为左旋多巴。反应25 h以后,左旋多巴的产量可以达到65 g/L,收率可达到92%。不过该酶催化体系存在一些缺点,当邻苯二酚及丙酮酸的底物浓度较高时,会对TPL产生抑制作用甚至导致酶失活。
3.3 转氨酶合成法转氨酶(transaminase)可将L-谷氨酸中的氨基转移到3, 4-二羟基苯丙酮酸上,进而生成左旋多巴,如Nagasaki等[14]研究了Enterobacter cloacae NB320转氨基反应合成左旋多巴的能力。由于转氨作用存在着诸多问题,随后利用转氨酶合成左旋多巴的相关研究比较少见。
4 基因工程策略合成左旋多巴20世纪90年代初人们开始运用基因工程的方法来获得生产左旋多巴的工程菌株。1990年Kurusu等[15]构建了pGRY30-TPL质粒,它能在Escherichia coli中能高效地表达产生酪氨酸酚解酶(TPL),该酶可以催化丙酮酸、邻苯二酚、氨水合成左旋多巴。1992年Suzuki等[16]将Erwinia herbicola AJ2982的TPL基因克隆到E.coli中进行表达,再将培养的细胞转入多巴合成体系中,反应30 h后,反应液中多巴含量为20.7 g/L。Enei等[17]和Katayama[18]选用Erwinia herbicola ATCC 21434为生产菌株,通过对合成工艺的改进,将L-DOPA产量提高到58 g/L,并于1993年在味之素公司投入工业化生产。Katayama等[19]对Erwinia herbicola菌株进行基因工程改造来合成左旋多巴。他们通过随机突变筛选得到tyrR的突变体V67A、Y72C、E201G,突变体提高了酪氨酸酚解酶基因的表达量,从而提高了左旋多巴的合成速率,其发酵末期左旋多巴产率由0.357 g/(L·h)提高到11.1 g/(L·h)。
Muñoz等[20]改造大肠杆菌莽草酸代谢途径合成左旋多巴。为给酪氨酸的代谢合成提供足够的前体物,需要增加磷酸烯醇式丙酮酸(PEP)和4-磷酸赤藓糖(E4P)的积累。他们先敲除葡萄糖磷酸烯醇式转移酶系统(PTS)和过表达转酮醇酶基因(tktA),使得L-酪氨酸的比生产速率提高3倍;然后,通过定点突变DAHP合成酶基因(aroFfbr)解除酪氨酸的反馈抑制;再敲除酪氨酸合成代谢中的抑制因子基因(tyrR),使得L-酪氨酸的比生产速率又提高1.9倍;最后通过过表达分支酸变位酶基因(tyrA)和来源于Zymomonas mobilis的环己二烯脱氢酶基因(tyrC),进一步过表达4-羟基苯乙酸3-羟化酶基因(hpaBC),实现L-酪氨酸向L-左旋多巴转化。使用该工程菌在无机盐培养基中发酵,左旋多巴比生产速率达13.6 mg/(g·h),得率为51.7 mg/g;在发酵罐中分批补料发酵50 h,左旋多巴产量达到1.51 g/L。Wei等[21]对大肠杆菌进行基因组进行如下改造(图 2):敲除转录调控因子tyrR 和碳源调节因子csrA得到AROM-1,左旋多巴摇瓶产量达148 mg/L;敲除葡萄糖磷酸烯醇式转移酶系统(PTS)得到AROM-2,左旋多巴产量达到170 mg/L;用P37启动子分别替换galP、glk的启动子得到AROM-3,左旋多巴产量达到205 mg/L;敲除酪氨酸竞争途径基因zwf和pheA得到TYR-1,其左旋多巴产量达到209.2 mg/L;在TYR-1的基因组上调控整合tyrAfbr-tyrB-hpaBC得到DOPA-1,左旋多巴产量达到307.4 mg/L;最后DOPA-1通过MAGE(multiplex automated genome engineering)方法逐步得到DOPA-30N,左旋多巴产量达到614.4 mg/L(每一步都是在上一步的基础上进行)。该工程菌在5 L发酵罐发酵60 h的左旋多巴产量达到8.67 g/L,是当时文献报道的最高产量。笔者所在实验室前期构建高产3-脱氢莽草酸(DHS)工程菌[22],该工程菌通过对基因组上的galP、glk、pgi、pykAF、aroF、aroE、tktA等10个基因进行优化调控,后期在5 L发酵罐中以无机盐为培养基补料葡萄糖发酵培养52 h,3-脱氢莽草酸产量达到94.4 g/L。在该工程菌的基础上,通过把启动子M1-93[23]整合替换到基因组aroE、tyrAfbr、hpaBC 3个合成左旋多巴关键基因的启动子位点上,得到工程菌T003(图 3)。该菌在5 L发酵罐上用无机盐培养基补料葡萄糖发酵培养60 h,左旋多巴产量可以达到60.4 g/L(数据未发表),葡萄糖糖酸摩尔转化率为16.8%,该菌初步具备进一步工业化生产的潜力。
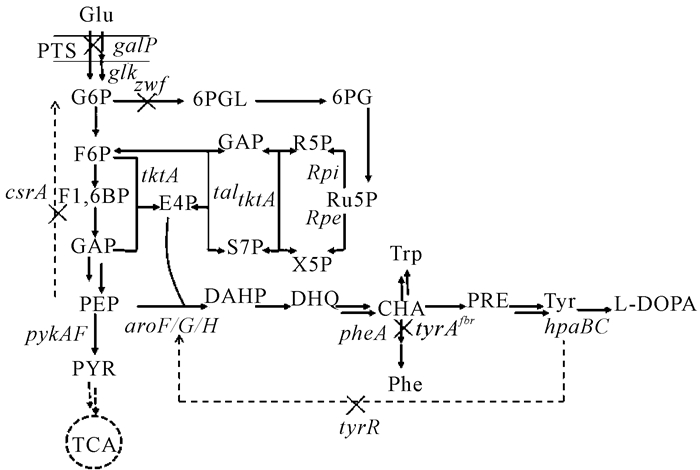
|
The "×" indicates that the genes are deleted.PTS:Phosphotransferase system; TCA:Tricarboxylic acid cycle; G6P:Glucose 6-phosphate; 6PGL:6-phospho D-glucono-1, 5-lactone; 6PG:6-phospho D-glucono; Ru5P:D-ribulose 5-phosphate; X5P:D-xylulose 5-phosphate; R5P:D-ribose 5-phosphate; S7P:D-sedoheptulose 7-phosphate; F6P:Fructose 6-phosphate; F1, 6BP:Fructose 1, 6-bisphosphate; GAP:Glyceraldehyde 3-phosphate; E4P:D-erythrose 4-phosphate; PEP:Phosphoenolpyruvate; PYR:Pyruvate; DAHP:3-Deoxy-arabino-heptulonate 7-phosphate; DHQ:3-Dehydroquinate; CHA:Chorismate; PRE:Prephenate; Tyr:L-tyrosine.tyrA:CHA mutase/prephenate dehydrogenase gene; pheA:Prephenate dehydratase gene; hpaBC:p-hydroxyphenylacetate 3-hydroxylase gene; galP:Galactose permease gene; glk:Glucokinase gene; zwf:Glucose-6-phosphate dehydrogenase gene; tktA:Transketolase Ⅰ gene; pykAF:Pyruvate kinase Ⅰ/Ⅱ gene; aroF, aroG and aroH:DAHP synthase gene; csrA, Carbon storage regulator A; tyrR:Tyrosine repressor; tal:Transaldolase; Rpi:Ribose 5-phosphate isomerase; Rpe:Ribulose-5-phosphate 3-epimerase 图 2 大肠杆菌左旋多巴生物合成和调控的代谢途径 Fig.2 Metabolic pathways involved in L-DOPA biosynthesis and regulation in E.coli |
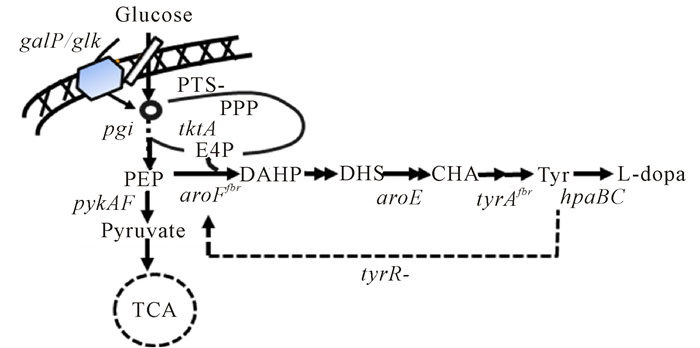
|
The "-" indicates that the genes are deleted.PTS:Phosphotransferase system; TCA:Tricarboxylic acid cycle; PPP, Pentose phosphate pathway; pgi:Glucosephosphate isomerase; E4P:D-erythrose 4-phosphate; PEP:Phosphoenolpyruvate; DAHP:3-Deoxy-arabino-heptulonate 7-phosphate; DHS:3-Dehydroshikimate; CHA:Chorismate; Tyr:L-tyrosine; tyrA:CHA mutase/prephenate dehydrogenase gene; aroE:Dehydroshikimate reductase gene; hpaBC:p-hydroxyphenylacetate 3-hydroxylase gene; galP:Galactose permease gene; glk:Glucokinase gene; tktA:Transketolase Ⅰ gene; pykAF:Pyruvate kinase Ⅰ/Ⅱ gene; aroF:DAHP synthase gene; tyrR:Tyrosine repressor 图 3 大肠杆菌T003左旋多巴生物合成途径 Fig.3 The biosynthetic pathways of L-DOPA in E.coli T003 |
随着我国人口老龄化速度的加快,对左旋多巴的需求将迅速增加。化学合成、植物提取、酶催化合成存在成本高、环境三废污染、原料来源有限等诸多问题,而微生物发酵法生产左旋多巴具有环境友好、产品品质高等优点,是今后生产左旋多巴研究的主要方向。以往含有质粒的大肠杆菌工程菌株由于受到抗生素抗性的胁迫性,导致不同批次发酵产量的不稳定。我们在大肠杆菌基因组上通过协调合成左旋多巴关键基因的表达水平,实现合成左旋多巴的代谢途径的平衡,构建出高效发酵生产左旋多巴的微生物细胞工厂。由于该菌在5 L发酵罐中的发酵后期溶氧水平较低(10%以内),导致其发酵产物中有少量的酪氨酸残留,这给后续的提取工作带来一定难度。后期需要优化发酵工艺,以及调整搅拌桨形状、大小来提高发酵的溶氧水平,从而减少发酵液中的酪氨酸残留;同时需要解决酶和细胞的生物体活性、耐受性、稳定性等科技问题,进一步缩短发酵周期,以提高微生物发酵法生产左旋多巴的市场竞争性。
| [1] |
POEWE W, ANTONINI A, ZIJLMANS J, et al. Levodopa in the treatment of Parkinson's disease:An old drug still going strong[J]. Clinical Interventions in Ageing, 2010, 5: 229-238. |
| [2] |
ABBOTT A. Levodopa:The story so far[J]. Nature, 2010, 466: S6-S7. |
| [3] |
陈红. 令人鼓舞的治疗帕金森氏病新药[J]. 国外药讯, 1996, 110: 17-18. CHEN H. Encouraging new drugs for Parkinson's disease[J]. World Pharmaceutical Newsletter, 1996, 110: 17-18. |
| [4] |
刘爽, 张玉莲, 周震. 老年性痴呆流行病学研究现况[J]. 中国老年学杂志, 2010, 30(10): 1455-1457. LIU S, ZHANG Y L, ZHOU Z. Current status of epidemiological studies on Alzheimer's disease[J]. Chinese Journal of Gerontology, 2010, 30(10): 1455-1457. DOI:10.3969/j.issn.1005-9202.2010.10.069 |
| [5] |
KATZENSCHLAGER R, LEES A J. Treatment of parkinsion's disease:Levodopa as the first choice[J]. J Neurol, 2002, 249(Suppl 2): 19-24. |
| [6] |
HUYNH T. The Parkinson's disease market[J]. Nature Reviews Drug Discovery, 2011, 10: 571-572. DOI:10.1038/nrd3515 |
| [7] |
VALDÉS R H, PUZER L, JR GOMES M, et al. Production of L-DOPA under heterogeneous asymmetric catalysis[J]. Catalysis Communications, 2004, 5(10): 631-634. DOI:10.1016/j.catcom.2004.07.018 |
| [8] |
CASSANI E, CILIA R, LAGUNA J, et al. Mucuna pruriens for Parkinson's disease:Low-cost preparation method, laboratory measures and pharmacokinetics profile[J]. J Neurol Sci, 2016, 365: 175-180. DOI:10.1016/j.jns.2016.04.001 |
| [9] |
黄增琼, 蒋伟哲, 巫世红. 猫豆的研究进展[J]. 中国药业, 2008, 17(24): 15-16. HUANG Z Q, JIANG W Z, WU S H. Research progress of seed of Stizolobium cochinchinensis[J]. China Pharmaceuticals, 2008, 17(24): 15-16. DOI:10.3969/j.issn.1006-4931.2008.24.013 |
| [10] |
马强强, 赵广荣. 左旋多巴合成研究进展[J]. 化工进展, 2013, 32(6): 1367-1371. MA Q Q, ZHAO G R. Research progress in L-DOPA synthesis[J]. Chemical Industry and Engineering Progress, 2013, 32(6): 1367-1371. |
| [11] |
KRISHNAVENI R, RATHOD V, THAKUR M S, et al. Transformation of L-tyrosine to L-dopa by a novel fungus, Acremonium rutilum, under submerged fermentation[J]. Current Microbiology, 2009, 58(2): 122-128. DOI:10.1007/s00284-008-9287-5 |
| [12] |
FITZPATRICK P F. Mechanism of aromatic amino acid hydroxylation[J]. Biochemistry, 2003, 42(48): 14083-14091. DOI:10.1021/bi035656u |
| [13] |
LEE S G, HONG S P, SUNG M H. Development of an enzymatic system for the production of dopamine[J]. Enzyme and Microbial Technology, 1999, 25: 298-302. DOI:10.1016/S0141-0229(99)00071-X |
| [14] |
NAGASAKI T, SUGITIA M, FUKAWA H, et al. DOPA production with Enterobacter cloacae NB320 by transaminase reaction[J]. Agriculture Biology and Chemistry, 1975, 39(2): 363-369. |
| [15] |
KURUSU Y, FUKUSHIMA M, KOHAMA K, et al. Cloning and nucleotide sequencing of the tyrosine phenol Iyase gene from Escherichia intermedia[J]. Biotechnol Lett, 1991, 13(11): 769-772. DOI:10.1007/BF01026756 |
| [16] |
SUZUKI H, NISHIHARA K, USUI N, et al. Cloning and nucleotide sequence of Erwinia herbicola AJ2982 tyrosine phenol-lyase gene[J]. Journal of Fermentation and Bioengineering, 1993, 75(2): 145-148. DOI:10.1016/0922-338X(93)90226-X |
| [17] |
ENEI H, NAKAZAWA H, YAMADA H. Enzymatic preparation of L-tyrosine or 3, 4-dihydroxyphenyl-l-alanine from pyruvate, ammonia and phenol or pyrocatechol[J]. Febs Letters, 1972, 21(1): 39-41. DOI:10.1016/0014-5793(72)80157-1 |
| [18] |
KATAYAMA T, SUZUKI H, KOYANAGI T, et al. Cloning and random mutagenesis of the Erwinia herbicola tyrR gene for high-level expression of tyrosine phenol-lyase[J]. Appl Environ Microbiol, 2000, 66(11): 4764-4771. DOI:10.1128/AEM.66.11.4764-4771.2000 |
| [19] |
KATAYAMA T, SUZUKI H, KOYANAGI T, et al. Cloning and random mutagenesis of the Erwinia herbicola tyrR gene for high-level expression of tyrosine phenol-lyase[J]. Applied and Environmental Microbiology, 2000, 66(11): 4764-4771. DOI:10.1128/AEM.66.11.4764-4771.2000 |
| [20] |
MUÉOZ A J, HERNÁNDEZ-CHÁVEZ G, DE ANDA R, et al. Metabolic engineering of Escherichia coli for improving L-3, 4dihydroxyphenylalanine (L-DOPA) synthesis from glucose[J]. Journal of Industrial Microbiology and Biotechnology, 2011, 38(11): 1845-1852. DOI:10.1007/s10295-011-0973-0 |
| [21] |
WEI T, CHENG B Y, LIU J Z. Genome engineering Escherichia coli for L-DOPA overproduction from glucose[J]. Scientific Reports, 2016, 6: 30080. DOI:10.1038/srep30080 |
| [22] |
吴凤礼, 彭彦峰, 徐毅诚, 等. 代谢工程改造微生物生产芳香族化合物的研究进展[J]. 生物加工过程, 2017, 15(5): 9-23. WU F L, PENG Y F, XU Y C, et al. Advances in microbial metabolic engineering for producing aromatic chemicals[J]. Chinese Journal of Bioprocess Engineering, 2017, 15(5): 9-23. |
| [23] |
LU J, TANG J L, LIU Y, et al. Combinatorial modudulation of galP and glk gene expression for improved alternative glucose utilization[J]. Applied Microbiology and Biotechnology, 2012, 93(6): 2455-2462. DOI:10.1007/s00253-011-3752-y |
 2018, Vol. 25
2018, Vol. 25 


