2. 大连医科大学公共卫生学院,辽宁大连 116044;
3. 奥古斯塔大学佐治亚医学院药理与毒理学系,佐治亚州奥古斯塔 30912
2. Public Health College, Dalian Medical University, Dalian, Liaoning, 116044, China;
3. Department of Pharmacology and Toxicology, Medical College of Georgia, Augusta University, Augusta, GA 30912, America
泛素-蛋白酶体系统(ubiquitin-proteasome system,UPS)是真核细胞降解蛋白质的主要途径。UPS介导的蛋白降解主要包括两个步骤:一是将小分子量的泛素蛋白(ubiquitin, Ub)连接到底物蛋白,即底物蛋白的泛素化;二是蛋白酶体降解泛素修饰的蛋白质,即靶蛋白的识别与降解。越来越多的研究证实,UPS作为维持细胞稳态的关键过程,其功能异常是导致心肌病、癌症、代谢障碍和神经退行性疾病等多种疾病的危险因素[1]。
泛素与蛋白底物的连接是UPS降解蛋白的关键信号,决定靶蛋白的命运。泛素是泛素超家族中最具代表性的成员,通过E1激活酶、E2结合酶和E3连接酶等酶促级联反应与靶蛋白偶联。蛋白质的这种泛素化修饰是可逆的,可通过去泛素化酶家族进行蛋白质的去泛素化。除泛素之外,泛素超家族还含有NEDD8、SUMO、FAT10、ISG15、ATG8、ATG1、HUB1和FUB1等类泛素蛋白(ubiquitin-like proteins)[1-2]。这些类泛素蛋白不仅与泛素具有序列同源性和相似的三级结构,而且还利用与泛素化修饰相似的级联反应来修饰靶蛋白。类泛素蛋白通常为非功能性前体蛋白,这些前体蛋白只有裂解C末端氨基酸成为成熟蛋白后,才能与E1激活酶、E2结合酶和E3连接酶形成临时复合物,使其靶蛋白底物被偶联。这种类泛素化修饰的特异性是由E3连接酶决定的。与泛素化一样,类泛素化修饰也能被去偶联酶从底物上去除[3]。
尽管类泛素化蛋白在蛋白质结构上与泛素具有同源性和相似性,但每个类泛素蛋白都有其特异的生物学功能。多个实验证实,基因敲除类泛素或类泛素修饰关键酶可导致小鼠发育异常及胚胎期间早死。在泛素超家族中,NEDD8在结构上与泛素同源性最高,是生物过程中不可或缺的一个类泛素蛋白,其在酶的作用下与靶蛋白的特异性结合过程被称为neddylation。本文首先将阐述neddylation的生物学过程,进而讨论其在心脏中的生理病理学功能。
1 NEDD8蛋白1993年,研究者首次从小鼠胚胎脑组织中克隆出NEDD8[4]。在类泛素蛋白超家族中,NEDD8与泛素的同源性最高,高达80%,并也包含1个α-螺旋和3个β-薄层结构。NEDD8在进化上完全保守,人类、小鼠和大鼠的同源性为100%。NEDD8在全身各个组织脏器均有表达,但在心脏和骨骼组织中的表达量最高[5]。
在哺乳动物中,NEDD8首先被合成为含有81个氨基酸的前体蛋白[4]。NEDD8前体在水解酶的作用下去除C末端的5个氨基酸,暴露76位的甘氨酸,继而与底物赖氨酸残基结合,从而修饰底物蛋白。多种同工酶能够催化NEDD8水解成熟,包括NEDD8特异性蛋白酶1(NEDD8-specific deneddylase NEDP1,也被称为DEN1和SENP8), NEDD8、Ub双特异性酶USP21和泛素C端水解酶LC3(Ubiquitin C-terminal hydrolase LC3,UCH-LC3)[5-7]。NEDD 8水解成熟一方面可防止未成熟前体进入类泛素化修饰过程;另一方面,NEDD8前体可作为NEDD8的储备池,避免NEDD8水平的波动,而在某些应激环境下,NEDD8含量的变化可能对细胞造成灾难性的后果。
2 Neddylation和deneddylation 2.1 NeddylationNeddylation过程中,成熟的NEDD8首先被ATP依赖性的NEDD8激活酶(NEDD8 activating enzyme,NAE,即E1)激活,NAE由异二聚体NAE1(也称为APP-BP1)和UBA3组成,NEDD8与NAE在ATP的作用下,通过硫酯键形成NEDD8-NAE加合物。然后,NEDD8-NAE加合物转移至NEDD8结合酶UBC12(也称为UBE2M或UBE2F,即E2),二者形成另一个硫酯键。最后,NEDD8连接酶(E3)短暂地与带有NEDD8的E2相互作用,通过在NEDD8 C端甘氨酸与底物赖氨酸残基形成异构肽将NEDD8转移至底物上。然后E3将E2释放,接受下一个带有NEDD8的E2,进入下一个循环[8-9]。腺苷氨基磺酸盐类似物MLN4924可特异性地抑制E1,通过与NEDD8形成不可逆的共价加合物,阻止NAE的UBA3与NEDD8形成硫酯键,从而抑制NEDD8的活化和neddylation。
迄今为止,只有NAE一个E1和两个NEDD8特异性E2被发现,而NEDD8特异性E3连接酶有很多种。在酵母中,DCN1 (defective in cullin neddylation 1)是其E3连接酶;在哺乳动物细胞中,至少有5种DCN1类似的蛋白(DCNL)作为其E3连接酶[10]。另外,研究显示Mdm2、c-Cbl和IAP等泛素E3连接酶也可作为NEDD8 E3连接酶[11-17]。
2.2 Deneddylation底物的neddylation是一个动态过程,底物上的NEDD8在deneddylation酶的作用下被去除,称为deneddylation。Deneddylation酶包括CSN (CDP9 signalosome)、NEDP1、USP21、Ataxin-3、UCH-L1和UCH-L3,其中只有CSN和NEDP1是NEDD8特异性的,其他酶也能调节泛素化修饰的去泛素化[18-19]。
CSN是最具代表性的deneddylation酶,可以将NEDD8从Cullin蛋白和非Cullin蛋白上移除。CSN是由8个亚基(CSN1-8)组成的锌金属蛋白酶[20],这8个亚基都是保持其酶活性所必需的,任何1个亚基的缺失都使CSN复合酶数量减少,并抑制CSN的deneddylate功能[21-24]。
NEDP1是一种半胱氨酸蛋白酶,在NEDD8前体的水解成熟过程以及从结合蛋白上去除NEDD8中都发挥作用。功能缺失研究显示,如果将NEDP1催化单元的半胱氨酸突变为丙氨酸,其从非Cullin蛋白上移除NEDD8的功能将完全丧失[25]。但NEDP1是否能催化体内Cullin蛋白的deneddylation仍然存在争议。
3 Neddylation的心脏生物学功能心脏是胚胎发育过程第一个形成并发挥功能的器官,心脏结构和功能异常可诱发各种疾病。在正常人胚胎初始发育30 d内,胚胎心肌纤维形成肌小梁,肌小梁间有小梁间隙,肌小梁和小梁间隙交织组成海绵状结构。从胚胎发育5~8周开始,疏松的肌小梁间隙由心外膜至心内膜、由心底部至心尖部逐渐消失,使心室肌呈致密化改变。但如果在胚胎发育期间致密化过程失败,使得肌小梁异常粗大、突出,小梁隐窝持续存在,相应区域的致密心肌减少,心室壁肌层保留疏松状态,将导致心肌致密化不全(LVNC)等多种先天性心肌病。
与泛素化修饰不同,neddylation修饰靶蛋白并不使之降解,而是活化底物蛋白的一种手段。Neddylation修饰在细胞代谢和增殖的调控、细胞信号转导、蛋白质稳态、基因转录, 甚至线粒体翻转等方面发挥着重要作用。本实验室利用自行构建的心肌细胞NAE1敲除(cardiomyocyte-restricted NAE1 knockout,NAE1CKO,NAE1flox/flox/αMHCCre)小鼠模型和心脏CSN 8(eighth subunit of CSN)基因敲除小鼠模型[26-29],获得大量关于neddylation和deneddylation调控心脏生物学功能的证据。
3.1 Neddylation调控心脏发育在胚胎期和新生小鼠心脏内neddylation高度活跃,成年后活性逐渐下调,而neddylation受NAE1的调控。本实验室利用NAE1flox/flox和NAE1flox/+/αMHCCre小鼠配对出NAE1CKO小鼠模型,NAE1CKO小鼠心脏内neddylated cullin2、neddylated cullin4和neddylated总蛋白显著减少。与正常小鼠心脏相比,NAE1CKO小鼠心脏/体重比显着增加,心脏尺寸明显增大,且心肌细胞横截面积增加,Nappa,Nappb和Myh6等心肌肥厚重塑相关基因表达失调,提示NAE1CKO小鼠心脏肥大[26]。
为评估NAE1CKO小鼠心脏的功能,对出生1 d(P1)的NAE1CKO小鼠进行超声心动图检测,结果显示NAE1CKO小鼠的左心室收缩和舒张直径显著增加,左心室收缩期壁厚显著减少,射血分数仅约为对照心脏的50%,其心率也显着低于对照小鼠。NAE1CKO小鼠普遍表现出心力衰竭症状,出生后48~72 h出现紫绀和周围性水肿,7 d内死亡[26]。
为评估NAE1CKO小鼠的产前心脏功能,我们对18.5 d的NAE1CKO小鼠胚胎(E)进行超声心动图检测。结果显示,E18.5的NAE1CKO小鼠心脏功能明显受损,左心室(LV)壁减薄,LV和右心室(RV)扩张,射血分数显著降低[26]。
3.2 Neddylation调控心室壁发育在E14.5时,NAE1CKO小鼠心脏具有完整的室分离和流入、流出道结构,肌小梁和致密层的厚度正常。在E16.5时,NAE1CKO小鼠胚胎没有出现明显的心力衰竭征状,但体积明显增大。然而,HE染色和endomucin免疫染色显示NAE1CKO小鼠心脏的LV致密心肌变薄、小梁层增厚[26]。
P1的正常心脏呈现厚且紧致的心外膜心肌层,并有少量心内膜下小梁,表明心室壁成熟。而NAE1CKO小鼠心脏的左、右心室中都显示出明显较薄的致密层,非致密层与致密层比值明显增加,与LVNC的心室成熟障碍一致。这些结果表明NAE1敲除在妊娠后期导致心室发育不全和致密不完全,并致围产期心力衰竭[26]。
3.3 Neddylation调控心肌细胞增殖心脏的发育在胚胎期主要通过心肌细胞的增殖来完成,而心肌细胞增殖能力的破坏将影响小鼠心室成熟并导致LVNC发生,因此我们研究neddylation在发育过程中是否调节心肌细胞增殖。5-乙炔-2′-脱氧尿苷(EdU)掺入实验显示,在E14.5,NAE1CKO小鼠心脏和心肌致密层的EdU +心肌细胞明显少于对照组。在E16.5,心肌细胞的增殖能力进一步受损(E16.5下降约70%,E14.5下降约20%),致密层、小梁层和隔膜中增殖心肌细胞进一步减少。在P1后,心肌细胞的增殖能力仍被抑制。而末端脱氧核苷酸转移酶介导的dUTP缺口末端标记测定(TUNEL)法实验结果显示,P1后的NAE1CKO小鼠心脏中凋亡心肌细胞数量与对照组没有显著差异,提示NAE1缺乏对胚胎期心肌细胞存活的影响较小[26]。
为研究neddylation如何调节心肌细胞增殖,我们对P1的NAE1CKO小鼠心脏进行细胞周期基因的qPCR阵列分析。与正常心脏相比,NAE1CKO小鼠心脏的细胞周期活化因子Cnnd1和Cnnd3表达下调,细胞周期抑制因子Brca1、Cdkn1a、Cdkn2b、Rb1、Sfn、Trp63和Cdk5rap1的表达上调。MLN4924是一种有效的特异性NAE1抑制剂,可以消除NAE1介导的NEDD8活化并消除NADD。结果显示,MLN4924显著地减少新生大鼠心室心肌细胞(NRVCs)中的neddylated蛋白质,并使更多的细胞周期基因表达水平异常,表明neddylation以细胞自主的方式调节细胞周期因子表达[26]。
3.4 Neddylation调控Hippo-YAP通路Hippo-YAP途径通过调节心肌细胞增殖来控制心脏形态发生。此途径中,Hippo激酶Mst1、Mst2、LATS1、LATS2连续激活,介导Yes相关蛋白(YAP)127位的丝氨酸磷酸化并抑制其核转位和转录活性。MLN4924处理的心肌细胞内表达异常的Aukb、Cnna2、Cnnb1、Sfn等基因均是YAP的直接靶点。与正常对照组相比,NAE1CKO小鼠心脏的Mst1、LATS1、LATS2等Hippo激酶及其伴侣蛋白MOB1含量增多,LAST1/2、MOB1、YAP的磷酸化增多,核定位的YAP数量显著减少,YAP激活的基因Auroka、Aurokb、Cdc20和Cdc25b下调,而YAP抑制的基因Cdkn1a、Trp63上调。这些现象表明,NAE1CKO小鼠心脏中YAP信号传导受损。体外实验呈现类似结果:MLN4924处理的心肌细胞内YAP激活的基因下调,YAP抑制的基因上调,NRVCs增殖减少约80%,表明抑制neddylation将激活Hippo激酶并抑制YAP信号通路[26]。
3.5 NEDD8底物Cullin7调控Mst1的泛素化和降解实验表明,MLN4924显著提高NRVCs中Mst1和LATS2的稳定性,减少Mst1泛素化,提示neddylation控制Mst1的泛素化。而NEDD8底物Cullin 7(Cul7)沉默导致NRVCs中Mst1降解减慢、泛素化Mst1减少、Mst1明显增多,表明Cul7介导Mst1的泛素化和降解。同时,Cul7沉默使下游LATS1/2、MOB1和YAP的磷酸化水平增高,Hippo信号通路激活,显著抑制心肌细胞增殖。
上述结果表明,NEDD8底物Cul7充当泛素连接酶以促进Mst1降解,从而激活YAP信号传导和心肌细胞增殖(图 1)[26]。
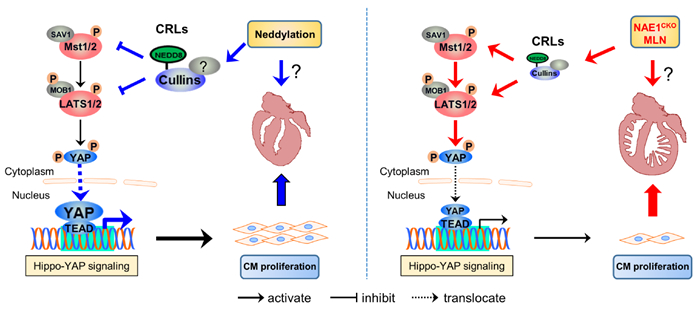
|
图 1 Neddylation通过抑制Hippo-YAP通路调控心脏成熟 Fig.1 Neddylation regulates heart developing by inhibiting Hippo-YAP pathway |
CSN8是最小和最不保守的CSN亚基。利用Cre-loxP技术,我们在围产期和成年阶段特异性去除小鼠心肌细胞的CSN8基因。新生小鼠心脏CSN8敲除使得CSN复合物形成障碍,从而蓄积大量neddylated cullins蛋白质和neddylated非cullins蛋白质,提示CSN8在deneddylation中发挥重要作用[30]。研究显示,与正常心脏相比,CSN8缺陷型心脏1周龄时无明显变化,2周龄时发生肥大,在3周龄时迅速进展为扩张型心肌病,收缩力和舒张性显著降低。新生CSN8缺陷小鼠在4周龄时最终死于心力衰竭[30]。同样,CSN8缺陷使得成年小鼠心脏deneddylation修饰功能异常,导致快速心力衰竭和死亡[31]。这些证据显示,CSN8调控的deneddylation是维持心脏结构和功能完整的关键。
4.1 CSN调控UPS介导的心脏蛋白水解蛋白酶体蛋白水解不充分是多种心脏疾病的重要致病因素。CSN能决定CRL(cullin RING ubiquitin ligases)的活性,被视为UPS的调控因子。研究显示,CSN8缺陷的小鼠心脏中蓄积大量UPS底物蛋白,同时泛素化蛋白、氧化蛋白及蛋白质聚集体明显增多,提示CSN8缺陷显著影响UPS功能[30-31]。而Hsp25、Hsp90和晶状体蛋白B(CryAB)等伴侣蛋白表达水平也明显升高,这可能是对蛋白毒性应激的适应性反应[30]。可见,CSN介导的deneddylation是心脏内蛋白酶体蛋白水解的关键,并可能与CSN8缺陷小鼠的心脏表型有关。
哺乳动物19S蛋白酶体的去泛素化酶(DUB)亚基RPN11将底物蛋白的泛素化和底物的蛋白酶体降解偶联起来。RPN11在将底物转移至20S蛋白酶体进行水解之前从底物上去除泛素。底物蛋白的去泛素化阻止底物降解,使泛素池的流量最小化。因此,RPN11是泛素化修饰快速高效降解底物所必需的。最近发现,在应激环境下NEDD8可以并入、覆盖泛素链。CSN在体内与蛋白酶体有相互作用,在体外将NEDD8从泛素链断开。因此,CSN可以通过以与RPN11处理泛素链相似的方式,将NEDD8从NEDD8-泛素链中脱帽,从而促进错误折叠的蛋白质降解。
4.2 CSN调节心脏内自噬性蛋白降解自噬是介导大量蛋白质降解的代谢过程。自噬过程始于粗面内质网的双层膜延伸、包裹细胞内需降解的细胞器、蛋白质等成分形成自噬体,并与溶酶体融合形成自噬溶酶体,利用溶酶体酶降解其所包裹的内容物。自噬的过度激活或抑制都可能导致心脏疾病的发生。
Deneddylation能调节心脏自噬。CSN8缺陷通过阻断自噬体清除,使得自噬体丰度增加,这一作用与自噬激活无关[31-32],而这种自噬体清除异常至少部分与自噬体与溶酶体融合障碍有关。Ras相关蛋白7(Rab7,小GTP酶家族成员)是调节自噬体成熟的关键蛋白,其下调可能导致CSN8缺陷心脏自噬体成熟障碍[32]。上述结果表明,CSN介导的deneddylation是自噬降解的关键,CSN8缺陷小鼠的心功能不全可能与自噬功能受损有关。
此外,neddylation也能调控自噬的激活。mTOR通路激活抑制自噬发生,而NAE抑制剂MLN294使癌细胞的CRL失活、mTOR抑制蛋白Deptor积聚,导致mTOR活性抑制和自噬激活[33]。而CRL组分ROC1的沉默也可使Deptor累积,从而抑制mTOR活性并诱导自噬[34]。
5 Neddylation与坏死坏死是与凋亡不同的一种细胞死亡形式。在CSN8缺陷小鼠的心脏中,观察不到凋亡细胞,却可见大量的坏死心肌细胞,提示坏死可能是心脏功能障碍的潜在机制。坏死心肌细胞在CSN8缺陷小鼠心脏的自噬囊泡内积累,提高自噬缺陷引起坏死性细胞死亡的可能性。事实上,自噬抑制、坏死和心脏疾病有关[35-36]。而在肝脏细胞内,CSN8缺陷能诱导肝细胞出现大量凋亡及功能受损[37-38],这表明CSN8缺陷诱导的细胞死亡可能是细胞类型特异性的。
坏死可以以高度调控和基因控制的方式发生。最近研究发现,RIPK1-RIPK3通路是TNFα诱导的调控性坏死的潜在机制[39],抑制RIPK1-RIPK3通路可保护心脏免受损伤[40-41]。值得注意的是,新型NEDD8连接酶IAP介导的NEDD8,能修饰RIPK1。在以后的工作中,将对CSN是否通过调节心脏中的RIPK1-RIK3途径来调节坏死开展相关工作。
6 展望大量报道已经揭示neddylation在心脏中的作用,但关于neddylation的研究仍有部分关键问题亟待解决:(1)Neddylation是否参与心脏疾病的发生发展,目前的研究结果都是基于细胞实验和动物模型,需要临床证据的支持;(2)Neddylation调控心脏的哪些信号通路, 除Hippo-YAP外,还有哪些通路在neddylation异常时参与心脏疾病的发生发展?(3)NEDD8修饰心脏的哪些底物蛋白,以及这些修饰如何调节心肌细胞中的蛋白功能。此外,靶向NEDD8激活酶的抑制剂MLN4924已进入治疗白血病和实体瘤的临床试验,以药剂为靶点的neddylation可能是临床药物开发的候选加工者。
| [1] |
GLICKMAN M H, CIECHANOVER A. The ubiquitin-proteasome proteolytic pathway:Destruction for the sake of construction[J]. Physiol Rev, 2002, 82(2): 373-428. DOI:10.1152/physrev.00027.2001 |
| [2] |
BEDFORD L, LOWE J, DICK L R, et al. Ubiquitin-like protein conjugation and the ubiquitin-proteasome system as drug targets[J]. Nat Rev Drug Discov, 2011, 10(1): 29-46. DOI:10.1038/nrd3321 |
| [3] |
KOMANDER D, CLAGUE M J, URBÉ S. Breaking the chains:Structure and function of the deubiquitinases[J]. Nat Rev Mol Cell Biol, 2009, 10(8): 550-563. DOI:10.1038/nrm2731 |
| [4] |
KUMAR S, YOSHIDA Y, NODA M. Cloning of a cDNA which encodes a novel ubiquitin-like protein[J]. Biochem Biophys Res Commun, 1993, 195(1): 393-399. DOI:10.1006/bbrc.1993.2056 |
| [5] |
KAMITANI T, KITO K, NGUYEN H P, et al. Characterization of NEDD8, a developmentally down-regulated ubiquitin-like protein[J]. J Biol Chem, 1997, 272(45): 28557-28562. DOI:10.1074/jbc.272.45.28557 |
| [6] |
GAN-ERDENE T, NAGAMALLESWARI K, YIN L, et al. Identification and characterization of DEN1, a deneddylase of the ULP family[J]. J Biol Chem, 2003, 278(31): 28892-28900. DOI:10.1074/jbc.M302890200 |
| [7] |
FRICKEL E M, QUESADA V, MUETHING L, et al. Apicomplexan UCHL3 retains dual specificity for ubiquitin and NEDD8 throughout evolution[J]. Cell Microbiol, 2007, 9(6): 1601-1610. DOI:10.1111/cmi.2007.9.issue-6 |
| [8] |
SOUCY T A, SMITH P G, MILHOLLEN M A, et al. An inhibitor of NEDD8-activating enzyme as a new approach to treat cancer[J]. Nature, 2009, 458(7239): 732-736. DOI:10.1038/nature07884 |
| [9] |
GONG L, YEH E T H. Identification of the activating and conjugating enzymes of the NEDD8 conjugation pathway[J]. J Biol Chem, 1999, 274(17): 12036-12042. DOI:10.1074/jbc.274.17.12036 |
| [10] |
KIM AY, BOMMELJÉ C C, LEE B E, et al. SCCRO (DCUN1D1) is an essential component of the E3 complex for neddylation[J]. J Biol Chem, 2008, 283(48): 33211-33220. DOI:10.1074/jbc.M804440200 |
| [11] |
MEYER-SCHALLER N, CHOU Y C, SUMARA I, et al. The human Dcn1-like protein DCNL3 promotes Cul3 neddylation at membranes[J]. Proc Natl Acad Sci U S A, 2009, 106(30): 12365-12370. DOI:10.1073/pnas.0812528106 |
| [12] |
BROEMER M, TENEV T, RIGBOLT K T G, et al. Systematic in vivo RNAi analysis identifies IAPs as NEDD8-E3 ligases[J]. Molecular Cell, 2010, 40(5): 810-822. DOI:10.1016/j.molcel.2010.11.011 |
| [13] |
EMBADE N, FERNÁNDEZ-RAMOS D, VARELA-REY M, et al. Murine double minute 2 regulates Hu antigen R stability in human liver and colon cancer through NEDDylation[J]. Hepatology, 2012, 55(4): 1237-1248. DOI:10.1002/hep.24795 |
| [14] |
HUANG G, KAUFMAN A J, RAMANATHAN Y, et al. SCCRO (DCUN1D1) promotes nuclear translocation and assembly of the neddylation E3 complex[J]. J Biol Chem, 2011, 286(12): 10297-10304. DOI:10.1074/jbc.M110.203729 |
| [15] |
WATSON I R, BLANCH A, LIN D C C, et al. Mdm2-mediated NEDD8 modification of TAp73 regulates its transactivation function[J]. J Biol Chem, 2006, 281(45): 34096-34103. DOI:10.1074/jbc.M603654200 |
| [16] |
XIRODIMAS D P, SAVILLE M K, BOURDON J C, et al. Mdm2-mediated NEDD8 conjugation of p53 inhibits its transcriptional activity[J]. Cell, 2004, 118(1): 83-97. DOI:10.1016/j.cell.2004.06.016 |
| [17] |
ZUO W, HUANG F, CHIANG Y J, et al. c-Cbl-mediated neddylation antagonizes ubiquitination and degradation of the TGF-beta type Ⅱ receptor[J]. Mol Cell, 2013, 49(3): 499-510. DOI:10.1016/j.molcel.2012.12.002 |
| [18] |
RABUT G, PETER M. Function and regulation of protein neddylation.'Protein modifications:Beyond the usual suspects' review series[J]. EMBO Rep, 2008, 9(10): 969-976. DOI:10.1038/embor.2008.183 |
| [19] |
XIRODIMAS D P. Novel substrates and functions for the ubiquitin-like molecule NEDD8[J]. Biochem Soc Trans, 2008, 36(Pt 5): 802-806. |
| [20] |
WEI N, SERINO G, DENG X W. The COP9 signalosome:More than a protease[J]. Trends Biochem Sci, 2008, 33(12): 592-600. DOI:10.1016/j.tibs.2008.09.004 |
| [21] |
LYKKE-ANDERSEN K, SCHAEFER L, MENON S, et al. Disruption of the COP9 signalosome Csn2 subunit in mice causes deficient cell proliferation, accumulation of p53 and cyclin E, and early embryonic death[J]. Mol Cell Biol, 2003, 23(19): 6790-6797. DOI:10.1128/MCB.23.19.6790-6797.2003 |
| [22] |
YAN J, WALZ K, NAKAMURA H, et al. COP9 signalosome subunit 3 is essential for maintenance of cell proliferation in the mouse embryonic epiblast[J]. Mol Cell Biol, 2003, 23(19): 6798-6808. DOI:10.1128/MCB.23.19.6798-6808.2003 |
| [23] |
TOMODA K, YONEDA-KATO N, FUKUMOTO A, et al. Multiple functions of Jab1 are required for early embryonic development and growth potential in mice[J]. J Biol Chem, 2004, 279(41): 43013-43018. DOI:10.1074/jbc.M406559200 |
| [24] |
MENON S, CHI H, ZHANG H, et al. COP9 signalosome subunit 8 is essential for peripheral T cell homeostasis and antigen receptor-induced entry into the cell cycle from quiescence[J]. Nat Immunol, 2007, 8(11): 1236-1245. DOI:10.1038/ni1514 |
| [25] |
MENDOZA H M, SHEN L N, BOTTING C, et al. NEDP1, a highly conserved cysteine protease that deNEDDylates Cullins[J]. J Biol Chem, 2003, 278(28): 25637-25643. DOI:10.1074/jbc.M212948200 |
| [26] |
ZOU J, MA W, LI J, et al. Neddylation mediates ventricular chamber maturation through repression of Hippo signaling[J]. Proc Natl Acad Sci USA, 2018, 115(17): E4101-E4110. DOI:10.1073/pnas.1719309115 |
| [27] |
WATSON I R, IRWIN M S, OHH M. NEDD8 pathways in cancer, Sine Quibus Non[J]. Cancer Cell, 2011, 19(2): 168-176. DOI:10.1016/j.ccr.2011.01.002 |
| [28] |
DUNCAN K, SCHAFER G, VAVA A, et al. Targeting neddylation in cancertherapy[J]. Future Oncol, 2012, 8(11): 1461-1470. DOI:10.2217/fon.12.131 |
| [29] |
NAWROCKI S T, GRIFFN P, KELLY K R, et al. MLN4924:A novel frst-in-class inhibitor of NEDD8-activating enzyme for cancer therapy[J]. Expert Opin Investig Drugs, 2012, 21(10): 1563-1573. DOI:10.1517/13543784.2012.707192 |
| [30] |
SU H, LI J, MENON S, et al. Perturbation of cullin deneddylation via conditional Csn8 ablation impairs the ubiquitin-proteasome system and causes cardiomyocyte necrosis and dilated cardiomyopathy in mice[J]. Circ Res, 2011, 108(1): 40-50. DOI:10.1161/CIRCRESAHA.110.230607 |
| [31] |
SU H, LI J, OSINSKA H, et al. The COP9 signalo-some is required for autophagy, proteasome-mediated proteolysis, and cardiomyocyte survival in adult mice[J]. Circ Heart Fail, 2013, 6(5): 1049-1057. DOI:10.1161/CIRCHEARTFAILURE.113.000338 |
| [32] |
SU H, WANG X. The ubiquitin-proteasome system in cardiac proteinopathy:A quality control perspective[J]. Cardiovasc Res, 2010, 85(2): 253-262. DOI:10.1093/cvr/cvp287 |
| [33] |
WANG X, ROBBINS J. Proteasomal and lysosomal protein degradation and heart disease[J]. J Mol Cell Cardiol, 2014, 71: 16-24. DOI:10.1016/j.yjmcc.2013.11.006 |
| [34] |
YANG D, LI L, LIU H, et al. Induction of autophagy and senescence by knockdown of ROC1 E3 ubiquitin ligase to suppress the growth of liver cancer cells[J]. Cell Death Differ, 2013, 20(2): 235-247. DOI:10.1038/cdd.2012.113 |
| [35] |
KOSTIN S, POOL L, ELSÄSSER A, et al. Myocytes die by multiple mechanisms in failing human hearts[J]. Circ Res, 2003, 92(7): 715-724. DOI:10.1161/01.RES.0000067471.95890.5C |
| [36] |
MIYATA S, TAKEMURA G, KAWASE Y, et al. Autophagic cardiomyocyte death in cardiomyopathic hamsters and its prevention by granulocyte colony-stimulating factor[J]. Am J Pathol, 2006, 168(2): 386-397. DOI:10.2353/ajpath.2006.050137 |
| [37] |
LEI D, LI F, SU H, et al. Hepatic defciency of COP9 signalosome subunit 8 induces ubiquitin-proteasome system impairment and Bim-mediated apoptosis in murine livers[J]. PLoS One, 2013, 8(7): e67793. DOI:10.1371/journal.pone.0067793 |
| [38] |
LEI D, LI F, SU H, et al. COP9 signalosome subunit 8 is required forpostnatal hepatocyte survival and effective proliferation[J]. Cell Death Differ, 2011, 18(2): 259-270. DOI:10.1038/cdd.2010.98 |
| [39] |
OERLEMANS M I, LIU J, ARSLAN F, et al. Inhibiti-on of RIP1-dependent necrosis prevents adverse cardiac remodeling after myocardial ischemia-reperfusion in vivo[J]. Basic Res Cardiol, 2012, 107(4): 270. DOI:10.1007/s00395-012-0270-8 |
| [40] |
LUEDDE M, LUTZ M, CARTER N, et al. RIP3, a kinase promoting necroptotic cell death, mediates adverse remodeling after myocardial infarction[J]. Cardiovasc Res, 2014, 103(2): 206-216. DOI:10.1093/cvr/cvu146 |
| [41] |
JONES J, WU K, YANG Y, et al. A targeted proteomic analysis of the ubiquitin-like modifer NEDD8 and associated proteins[J]. J Proteome Res, 2008, 7(3): 1274-1287. DOI:10.1021/pr700749v |
 2018, Vol. 25
2018, Vol. 25 


