枯草芽孢杆菌(Bacillus subtilis)作为一种好氧型革兰氏阳性细菌,是研究最早且最深入的一种芽孢杆菌[1]。因其为益生菌且具有良好的研究基础,而被作为微生物研究领域的一种重要模式菌株和宿主菌。营养的饥饿胁迫会诱导枯草芽孢杆菌营养体细胞由生殖生长期进入孢子休眠期,从而形成芽孢。芽孢是具有独特的构造和生理功能的圆形或椭圆形休眠体,从内向外依次由核心、皮层和芽孢衣组成[2],因其能在极端恶劣条件下存活而备受研究者关注。
表面展示技术是指通过基因工程技术将外源蛋白或多肽定位到噬菌体、细胞、酵母或芽孢表面的一种技术。首个表面展示系统由Smith等[3]于1985年利用丝状噬菌体M13的基因Ⅲ编码的外壳蛋白pⅢ使抗体固定在噬菌体表面,为抗原的生产提供了一种新的技术,其他表面展示技术如噬菌体[4]、细菌[5]、酵母[6]和芽孢表面展示技术便应运而生。芽孢表面展示技术是将编码外源蛋白的目的基因与含有自身启动子的芽孢衣壳蛋白基因融合,构建融合基因表达载体,然后将载体转化到产芽孢的宿主菌株中,得到的重组菌株在生孢培养基中培养使其芽孢化时,目标蛋白就会在锚定蛋白基因启动子的启动下表达,从而展示在芽孢表面。由于芽孢独特的抗逆性,能够抵御包括高温、干燥、紫外线、电离辐射和有毒的化学物质等不良环境,使得展示在芽孢表面的外源蛋白也具有相应的抗逆性;另外,与噬菌体、细菌或酵母细胞表面展示技术相比,芽孢表面展示技术还具有稳定性高、易纯化回收、无需跨膜、存在ATP依赖型分子伴侣、可表达分子量较大或多聚体外源蛋白和没有明显的密码子偏爱性等优点。目前芽孢展示技术主要应用在枯草芽孢杆菌上,相较于其他表面展示技术芽孢表面展示技术起步较晚,但由于宿主菌的益生性及芽孢独特的生理结构和抗逆性使得该技术兴起后应用极为广泛。Isticato等[7]首次利用芽孢锚定蛋白CotB将破伤风毒素(TTFC)末端的459个氨基酸片段成功地展示在芽孢表面,自此掀起将基因工程与芽孢表面展示技术相结合构建基因重组型芽孢表面展示系统的研究热潮。该项技术现已成功应用于生物降解、生物催化、医药、工业化酶及其他功能性蛋白生产等领域。
1 芽孢表面展示整合策略枯草芽孢杆菌芽孢表面展示技术现有基因重组方式和非基因重组方式两种展示策略。基因重组的芽孢表面展示技术是基于编码外源蛋白或多肽的基因与锚定蛋白的基因融合后,随着锚定蛋白的表达从而外源蛋白得以成功地展示在芽孢表面,且不影响芽孢自身的结构和功能。枯草芽孢杆菌芽孢表面展示系统根据所用载体的基因重组方式又可进一步分为游离型和整合型。游离型是指将锚定蛋白与外源蛋白的基因重组于游离型载体质粒中,导入宿主后在细胞染色体外进行独立的复制和表达。解决芽孢杆菌中高效表达外源蛋白重组质粒的不稳定性问题的最有效途径是使用整合型质粒。整合型是指在锚定蛋白和外源蛋白基因两端加入同源臂,经线性化处理后以双交换的方式插入宿主染色体内进行复制和表达,其中构建载体时多使用枯草芽孢杆菌的淀粉酶基因amyE(全长1 980 bp),通常以amyE为模板,克隆并形成两个同源臂,构建好的重组载体经线性化后导入受体感受态细胞,通过同源重组整合到宿主细胞的染色体上(图 1)。目前已有的研究中枯草芽孢杆菌芽孢表面展示外源蛋白构建的载体除少数为游离型载体外,几乎都是整合型载体,整合的策略有单交换和双交换,而双交换使用得更为频繁。游离型重组方式具有操作简单但质粒不稳定等特点,相反整合型重组方式遗传稳定性好。非基因重组方式的芽孢表面展示是将细菌芽孢与纯化的外源蛋白一起进行培养,由于两者之间存在静电作用、疏水相互作用力或使用交联剂如戊二醛等将外源蛋白锚定在芽孢表面[8-9]。本文主要对基因重组型枯草芽孢杆菌芽孢展示技术进行综述。
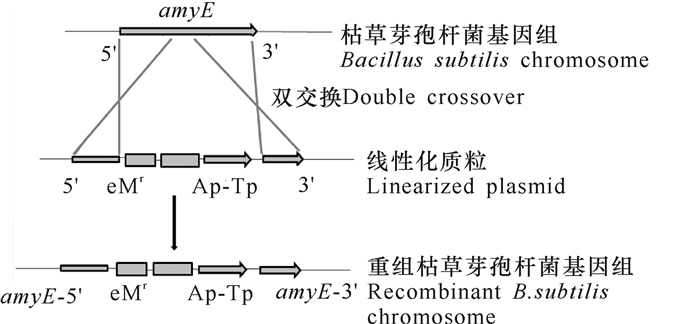
|
Ap:编码锚定蛋白的基因;Tp:编码目标蛋白的基因;amyE:淀粉酶基因 Ap:Anchored protein-encoding gene.Tp:Target protein-encoding gene.amyE:Amylase gene 图 1 通过整合型载体整合目的基因到枯草芽孢杆菌基因组的流程图 Fig.1 The flowchart of integrating target genes into Bacillus subtilis genome through an integrated vector |
要使外源蛋白成功展示在芽孢表面,锚定蛋白必须满足如下要求:(1)具有一个结构域,可使外源目的蛋白展示在芽孢表面;(2)具有强大的锚定结构域,能够与靶蛋白进行融合并牢固地展示在芽孢表面;(3)锚定蛋白与靶蛋白形成的融合蛋白不影响相互的功能;(4)必须具有一定的抵御培养基或周质空间中蛋白酶水解的能力;(5)载体的敲除不影响芽孢的正常发芽、成熟和分化。
枯草芽孢杆菌芽孢表面展示技术发展迅速,目前已通过CotB、CotC、CotG、CotZ、CotA、OxdD、CotE、CotZ、CgeA等多种锚定蛋白在枯草芽孢杆菌芽孢表面成功展示多种外源蛋白。其中研究较为深入的有CotB、CotC、CotG三种,这3类蛋白常以多聚体的形式存在于富含酪氨酸的芽孢衣外层中。CotB是首个应用于芽孢表面展示技术的芽孢外套蛋白,Isticato等[7]利用CotB作为芽孢表面展示外源抗原的融合载体蛋白,将来源于破伤风梭菌的TTFC蛋白展示在枯草芽孢杆菌芽孢表面,首次成功构建了芽孢表面展示系统。CotB和CotC主要用于提供表达抗原,而CotG多用于在芽孢表面锚定不同的酶,经CotG展示的外源蛋白已涉及单体、二聚体和四聚体等多种类型,表现出良好的应用潜力。Hinc等[10]分别将应用最多的三种锚定蛋白CotB、CotC和CotG与尿素酶的一个亚基(UreA)构建重组芽孢,再将蛋白质印迹法、免疫斑点法和免疫荧光显微镜测定结果进行比较,结果表明UreA在三种衣壳蛋白锚定下均可在芽孢表面有效表达,其中CotC表达效率最高(每个芽孢可展示7×103~15×103个重组分子),而CotB最适合在芽孢表面展示外源蛋白。Hinc等[11]提出了锚定蛋白不应只局限于CotB、CotC和CotG三种,将一种新的外套蛋白CotZ应用于该项技术,并且表明CotZ可以用以表达相对较大的客体蛋白,CotZ作为锚定蛋白时允许表达完整的UreA蛋白,但选择CotB或CotC为锚定蛋白时,无法进行完整蛋白的表达。Shraddha等[12]利用芽孢表面展示技术来研究芽孢外套蛋白CotA的定向进化,CotA是一种漆酶,有广泛的作用底物,利用易错PCR和DNA重组技术构建一个CotA基因的突变体库,将突变体库中CotA基因和野生型CotA基因的重组载体转化到枯草芽孢杆菌中,通过ABTS法和丁香醛联氮法测定野生型和突变型CotA的酶活,通过此方法对CotA基因进行定向改造。Hwang等[13]以GotG与CotE为锚定蛋白在芽孢表面成功展示了β-半乳糖苷酶,证实了多聚体酶的芽孢表面展示相对于营养细胞具有更高的展示效率。李倩等[14]为证明CotX能否作为分子载体,将CotX基因与绿色荧光蛋白基因gfp构建融合表达载体,观察到重组芽孢表面具有GFP绿色荧光,表明CotX可作为芽孢表面展示技术的锚定蛋白,随后又以CotX为分子载体表面展示了WSSV囊膜蛋白Vp19和Vp28。目前应用到的锚定蛋白大都属于外衣壳蛋白,Potot等[15]首次使用43.4 kDa的内衣壳蛋白OxdD作为锚定蛋白,与丰度更高的外套蛋白CotG进行比较,首先将饲料用酶(植酸酶)展示在芽孢表面并通过免疫荧光法分别测定酶活,结果显示两者展示的外源蛋白均具有酶活性,同时通过表达β-葡萄糖醛酸酶验证了OxdD可作为锚定蛋白表达分子量大的低聚体酶,从而表明内被蛋白有作为锚定蛋白的应用价值。Wang等[16]以CotX为锚定蛋白在枯草芽孢杆菌168孢子表面展示β-半乳糖苷酶,开发了一种新型乳果糖生物催化剂。Iwanicki等[17]分别用CotB, CotC, CotG, CotZ和CgeA五种外衣壳蛋白与CagA蛋白进行融合,从而得出CotB,CotC和CotG三种锚定蛋白在构建融合蛋白时有N端和C端融合两种方式,CotZ和CgeA仅仅适用于C端融合;同时在CgeA和CagA之间插入连接肽GGGEAAAKGGG与不插入进行对比,得出插入连接肽可增强芽孢表面展示外源蛋白的有效性。
3 芽孢表面展示技术的应用枯草芽孢杆菌芽孢表面展示技术已成功展示多种外源蛋白,该技术已被广泛应用于环境污染降解、口服疫苗与药物的制备、工业化酶的制备、大分子量和多聚体蛋白和其他生物活性酶的生产等方面。
3.1 环境污染的生物法治理枯草芽孢杆菌展示酶因环保性好和催化效率高等优点被用于环境污染的治理。Falahati-Pour等[18]使用1-(3-二甲氨基丙基)-3-乙基碳二亚胺和N-羟基硫代琥珀酰亚胺(EDC-NHS)作为交联剂,将有机磷水解酶共价锚定在芽孢表面,使得该酶在不同pH值和温度条件下的活性都显著提高,并且在6次循环使用后,酶活性几乎没有降低,循环使用10次后,仍能保持80%的酶活。为解决环境中有机磷农药环境残留问题提供了生物修复新方法。重金属污染问题亟待解决,Hinc等[19]提出枯草芽孢杆菌的重组芽孢可作为吸附镍离子的潜在生物修复工具,将CotB与组氨酸残基进行融合,分析野生型和重组芽孢以比较吸附镍离子的效率,结果证明后者具有更高的吸附效率。
3.2 口服疫苗和药物的制备枯草芽孢杆菌为益生菌,展示在芽孢表面的抗原因具有芽孢独特的抗逆性,可顺利通过胃肠屏障从而诱导机体产生保护性免疫反应,因此以芽孢表面展示技术制备口服抗原在疫苗制备领域得到更为广泛的应用。Ciabattini等[20]利用CotB将TTFC抗原展示在枯草芽孢表面,分别对两种实验小鼠进行口服免疫,再皮下注射TTFC,结果其体内的抗体含量可达到(1 200±370) ng/mL和(2 600±915) ng/mL,表明展示抗原的重组芽孢经口服即可引发免疫应答。Nguyen等[21]则针对感染对虾的白斑综合征病毒,通过CotB在枯草芽孢表面展示病毒的Vp28蛋白,对虾在饲喂重组芽孢后在抵御白斑综合征病毒的感染能力方面有了很大的提升,此研究结果提供了一种具有良好应用价值的新型疫苗。Wang等[22]在枯草芽孢杆菌芽孢表面展示华支睾吸虫的烯醇酶蛋白,以此制备的口服疫苗可在小鼠体内同时引发Ⅰ型、Ⅱ型细胞免疫反应,并产生特异性的IgG1和IgG2a抗体,经两次加强免疫后,小鼠的华支睾吸虫感染数量减少了60.07%、华支睾吸虫的产卵率减少了80.67%,产生了良好的免疫效果。由此可见,通过枯草芽孢杆菌芽孢表面展示技术能够制备具有良好免疫效果的重组芽孢。
人血清白蛋白(HSA)是人血浆的主要蛋白质组分,迄今为止,用于临床的HSA主要是通过人全血分离产生的,这是伴随着很多局限性的。Mao等[23]将HSA与CotC融合,使用Western blot和荧光免疫法来监测HSA在孢子上的表面表达,得出在芽孢表面展示的HSA占总孢子蛋白的0.135%,每个孢子的表面上暴露约0.023 fg的HSA,用重组蛋白对小鼠进行口服给药得出的抗性特征表明重组孢子可增加体内血清白蛋白。应用枯草芽孢杆菌芽孢成功展示的口服给药还有胰岛素和人类生长激素等[24-25]。Hinc等[26]首次同时用芽孢表面展示技术展示两种重组芽孢,分别携带抗原和佐剂,在口服免疫的小鼠中引发强烈的细胞免疫应答。
3.3 工业化酶的制备枯草芽孢杆菌芽孢表面展示技术因芽孢优良的抗逆性使得该酶具有良好的稳定性,可大大提高酶活进而增大底物转化率,通过芽孢表面展示的工业用酶还具有易纯化、回收率高等优势,可降低成本有助于产物的工业化生产。Guo等[27]通过使用锚定蛋白CotG和连接肽(GGGGS)将来源于短乳杆菌的L-阿拉伯糖异构酶(L-AI)展示在枯草芽孢杆菌DB403的芽孢表面,125 g/L的D-半乳糖生产D-塔格糖的转化率在28 h时达到79.7%,20 h时D-塔格糖的生产强度达到4.3 g/(L·h)。这种具有高比活性和稳定性的L-AI被用作分批和半连续生物转化生产D-塔格糖的新型固定化生物催化剂。此外,展示的L-AI在再利用性方面表现出良好的性能,5次再循环之后仍保持87%的比活性和40.7%的转化率。赵一瑾等[28]以CotC为分子载体在枯草芽孢杆菌表面展示海藻糖合酶(Tres),与底物浓度为30%的麦芽糖在50℃水浴条件下作用2 h,利用HPLC能够检测到海藻糖峰,通过计算得到的酶活为252 U/mL。Chen等[29]利用枯草芽孢杆菌芽孢表面展示技术将腈水解酶锚定在芽孢表面,实验证明融合腈水解酶的最适宜温度和pH值分别为50℃和8.0,均高于游离腈水解酶(45℃和7.5)。热稳定性和pH稳定性的分析表明,孢子表面展示的腈水解酶在75℃和pH值8.0下保温1 h后分别保留79%和97%,而游离腈水解酶分别为32%和52%;重复性实验表明,在整个重复利用过程中,腈水解酶活性没有明显下降,在第5个周期仍然保持了83%的初始活性。Wang等[16]将β-半乳糖苷酶(β-Gal)展示于芽孢表面,所得重组蛋白的最适pH值和温度分别为6.0和75℃,在最佳条件下,最大活性为0.42 U/mg(干重)。此外,芽孢展示的β-Gal可用作全细胞生物催化剂以生产乳果糖,以200 g/L的乳糖和100 g/L的果糖为底物时,乳果糖的产量为8.8 g/L。重复性实验显示,在连续的8个转化周期后仍有30.3%的重组芽孢保持最初的活性。另外,成功展示的工业化酶还有D-阿洛酮糖3-差向异构酶(DPEase)[30]、α淀粉酶[31]、酯酶DSM[32]、嗜热脂肪酶Tml350[33]、乙醇脱氢酶[34]、β-半乳糖苷酶[35-36]等。
3.4 大分子量和多聚体蛋白的生产芽孢表面展示技术因无需跨越细胞膜可将大分子量和多聚体形态外源蛋白正确表达于芽孢表面。Hwang等[37]提出利用芽孢表面展示技术进行多聚体蛋白质和含辅因子的酶的功能表达还有待研究,成功在枯草芽孢杆菌芽孢表面以CotG作为锚定蛋白展示二聚体状态下需要磷酸吡哆醛(PLP)作为高效转氨作用的辅助因子ω-转氨酶,为扩大目标蛋白应用范围提供理论依据。Wang等[16]成功将β-半乳糖苷酶展示在芽孢表面,与基于营养细胞的展示系统相比更利于保持外源蛋白的生物活性。链霉亲和素是另一种多聚体蛋白,在胞内表达时常与细胞内的生物素结合而影响宿主,当分泌表达或在其他表面展示系统中,其四聚体形态又会阻碍跨膜;Kim等[38]利用CotG为锚定蛋白将链霉亲和素成功展示在枯草芽孢杆菌芽孢表面,由于链霉亲和素在芽孢形成时表达,不需要穿过细胞膜便可直接展示在芽孢表面,既克服了链霉亲和素的细胞毒性,又不影响芽孢的结构完整性,以此方法获得的重组芽孢具有良好的生物活性。
3.5 其他生物活性酶的制备生物防治真菌等病原体被认为是最好的消除方法之一,几丁质酶能够抑制许多对全球农业生产构成威胁的真菌病害的增长。Rostami等[39]在枯草芽孢杆菌芽孢表面成功表达了几丁质酶作为生物防治剂,体外实验表明,该酶可有效抑制Rhizoctonia solani和Trichoderma harzianum真菌的生长。Potot等[15]将饲料用酶植酸酶展示在芽孢表面以生产动物益生菌。饲料酶必须在饲料制备和胃肠道的苛刻条件下保持活性,芽孢的强抗逆性使其可以用作改进生物活性分子制剂的创新工具。
4 展望综上,枯草芽孢杆菌芽孢表面展示技术由于其独特的优势已在多领域得以成功应用,多年来随着芽孢结构和装配机制研究日益深入以及已提出的利用多种锚定蛋白同时展示外源蛋白[17]、引入连接肽链[40]、提高外源基因拷贝数[41]等多种方法使枯草芽孢杆菌芽孢表面展示技术越来越成熟和完善,在现有应用领域的基础上进一步探索该技术更多的应用具有实际意义。枯草芽孢杆菌的益生性使得该技术可应用于食品与生物行业,且芽孢独特的抗逆性使得展示于芽孢表面的工业化酶具有更好的稳定性,固定化酶易纯化与可循环利用的优点也大大降低了工业化成本。枯草芽孢杆菌芽孢表面展示技术为提高工业化生产效率提供了可行性措施,同时为食品与生物的安全性提供保障。
| [1] |
余小霞, 田健, 伍宁丰. 枯草芽胞杆菌芽胞表面展示外源蛋白的研究进展[J]. 中国农业科技导报, 2013, 15(5): 31-38. YU X X, TIAN J, WU N F. Research progress on Bacillus subtilis spore display of recombinant proteins[J]. Journal of Agricultural Science and Technology, 2013, 15(5): 31-38. |
| [2] |
MCKENNEY P T, DRIKS A, EICHENBERGER P. The Bacillus subtilis endospore:Assembly and functions of the multilayered coat[J]. Nature Reviews Microbiology, 2013, 11(1): 33-44. DOI:10.1038/nrmicro2921 |
| [3] |
SMITH G P. Filamentous fusion phage:Novel expression vectors that display cloned antigens on the virion surface[J]. Science, 1985, 228(4705): 1315-1317. DOI:10.1126/science.4001944 |
| [4] |
JR T C. Discovery of phage display peptide ligands for species-specific detection of Bacillus spores[J]. Journal of Microbiological Methods, 2003, 53(2): 263-271. DOI:10.1016/S0167-7012(03)00030-7 |
| [5] |
HE M X, FENG H, ZHANG Y Z. Construction of a novel cell-surface display system for heterologous gene expression in Escherichia coli by using an outer membrane protein of Zymomonas mobilis as anchor motif[J]. Biotechnology Letters, 2008, 30(12): 2111-2117. DOI:10.1007/s10529-008-9813-3 |
| [6] |
DURAUER A, BERGER E, ZANDIAN M, et al. Yeast cell surface display system for determination of humoral response to active immunization with a monoclonal antibody against EpCAM[J]. Journal of Biochemical and Biophysical Methods, 2008, 70(6): 1109-1115. DOI:10.1016/j.jprot.2008.01.008 |
| [7] |
ISTICATO R, CANGIANO G, TRAN H T, et al. Surface display of recombinant proteins on Bacillus subtilis spores[J]. Journal of Bacteriology, 2001, 183(21): 6294-6301. DOI:10.1128/JB.183.21.6294-6301.2001 |
| [8] |
RICCA E, BACCIGALUPIL, CANGIANO G, et al. Mucosal vaccine delivery by non-recombinant spores of Bacillus subtilis[J]. Microbial Cell Factories, 2014, 13(1): 1-9. DOI:10.1186/1475-2859-13-1 |
| [9] |
POTOCKI W, NEGRI A, PESZYNSKA-SULARZ G, et al. The combination of recombinant and non-recombinant Bacillus subtilis spore display technology for presentation of antigen and adjuvant on single spore[J]. Microbial Cell Factories, 2017, 16(1): 151. DOI:10.1186/s12934-017-0765-y |
| [10] |
HINC K, ISTICATO R, DEMBEK M, et al. Expression and display of UreA of Helicobacter acinonychis on the surface of Bacillus subtilis spores[J]. Microbial Cell Factories, 2010, 9(1): 1-11. DOI:10.1186/1475-2859-9-1 |
| [11] |
HINC K, IWANICKI A, OBUCHOWSKI M. New stable anchor protein and peptide linker suitable for successful spore surface display in B.subtilis[J]. Microbial Cell Factories, 2013, 12(1): 22. DOI:10.1186/1475-2859-12-22 |
| [12] |
SHRADDHA, SHEKHER R, SEHGAL S, et al. Laccase:Microbial sources, production, purification, and potential biotechnological applications[J]. Enzyme Research, 2011, 23(1): 29-60. |
| [13] |
HWANG B Y, PAN J G, KIM B G, et al. Functional display of active tetrameric beta-galactosidase using Bacillus subtilis spore display system[J]. Journal of Nanoscience & Nanotechnology, 2013, 13(3): 2313-2319. |
| [14] |
李倩, 宁德刚, 吴春笃. 以CotX为分子载体在枯草芽胞杆菌芽胞表面展示绿色荧光蛋白[J]. 生物工程学报, 2010, 26(2): 264-269. LI Q, NING D G, WU C D. Surface display of GFP using CotX as a molecular vector on Bacillus subtilis spores[J]. Chinese Journal of Biotechnology, 2010, 26(2): 264-269. |
| [15] |
POTOT S, SERRA C R, HENRIQUES A O, et al. Display of recombinant proteins on Bacillus subtilis spores, using a coat-associated enzyme as the carrier[J]. Applied and Environmental Microbiology, 2010, 76(17): 5926-5933. DOI:10.1128/AEM.01103-10 |
| [16] |
WANG H, YANG R, HUA X, et al. An approach for lactulose production using the CotX-mediated spore-displayed β-galactosidase as a biocatalyst[J]. Journal of Microbiology and Biotechnology, 2016, 26(7): 1267-1277. DOI:10.4014/jmb.1602.02036 |
| [17] |
IWANICKI A, PIATEK I, STASILOJC M, et al. A system of vectors for Bacillus subtilis spore surface display[J]. Microbial Cell Factories, 2014, 13(1): 1-9. DOI:10.1186/1475-2859-13-1 |
| [18] |
FALAHATI-POUR S K, LOTFI A S, AHMADIAN G, et al. Covalent immobilization of recombinant organophosphorus hydrolase on spores of Bacillus subtilis[J]. Journal of Applied Microbiology, 2015, 118(4): 976. DOI:10.1111/jam.2015.118.issue-4 |
| [19] |
HINC K, GHANDILI S, KARBALAEE G, et al. Efficient binding of nickel ions to recombinant Bacillus subtilis spores[J]. Research in Microbiology, 2010, 161(9): 757-764. DOI:10.1016/j.resmic.2010.07.008 |
| [20] |
CIABATTINI A, PARIGI R, ISTICATO R, et al. Oral priming of mice by recombinant spores of Bacillus subtilis[J]. Vaccine, 2004, 22(32): 4139-4143. |
| [21] |
NGUYEN A T, PHAM C K, PHAM H T, et al. Bacillus subtilis spores expressing the VP28 antigen:A potential oral treatment to protect Litopenaeus vannamei against white spot syndrome[J]. FEMS Microbiology Letters, 2014, 358(2): 202-208. DOI:10.1111/fml.2014.358.issue-2 |
| [22] |
WANG X, CHEN W, TIAN Y, et al. Surface display of Clonorchis sinensis enolase on Bacillus subtilis spores potentializes an oral vaccine candidate[J]. Vaccine, 2014, 32(12): 1338-1345. DOI:10.1016/j.vaccine.2014.01.039 |
| [23] |
MAO L, JIANG S, LI G, et al. Surface display of human serum albumin on Bacillus subtilis spores for oral administration[J]. Current microbiology, 2012, 64(6): 545-551. DOI:10.1007/s00284-012-0109-4 |
| [24] |
FENG F, HU P, CHEN L, et al. Display of human proinsulin on the Bacillus subtilis spore surface for oral administration[J]. Current Microbiology, 2013, 67(1): 1-8. DOI:10.1007/s00284-013-0325-6 |
| [25] |
LIAN C, ZHOU Y, FENG F, et al. Surface display of human growth hormone on Bacillus subtilis spores for oral administration[J]. Current Microbiology, 2014, 68(4): 463-471. DOI:10.1007/s00284-013-0500-9 |
| [26] |
HINC K, PIATEK I, PESZYИ-SKASULARZ G, et al. Mucosal adjuvant activity of IL-2 presenting spores of Bacillus subtilis in a murine model of helicobacter pylori vaccination[J]. PLOS ONE, 2014, 9(4): e95187. DOI:10.1371/journal.pone.0095187 |
| [27] |
GUO Q, AN Y F, YUN J H, et al. Enhanced D-tagatose production by spore surface-displayed L-arabinose isomerase from isolated Lactobacillus brevis PC16 and biotransformation[J]. Bioresource Technology, 2018, 247: 940-946. DOI:10.1016/j.biortech.2017.09.187 |
| [28] |
赵一瑾, 王腾飞, 汪俊卿, 等. 以CotC为分子载体在枯草芽孢杆菌表面展示海藻糖合酶[J]. 中国生物工程杂志, 2017, 37(1): 71-80. ZHAO Y J, WANG T F, WANG J Q, et al. Trehalose synthase on the surface of Bacillus subtilis spore with CotC as a molecular carrier[J]. China Biotechnology, 2017, 37(1): 71-80. |
| [29] |
CHEN H, CHEN Z, NI Z, et al. Display of Thermotoga maritima MSB8 nitrilase on the spore surface of Bacillus subtilis using out coat protein CotG as the fusion partner[J]. Journal of Molecular Catalysis B:Enzymatic, 2016, 123: 73-80. DOI:10.1016/j.molcatb.2015.11.002 |
| [30] |
HE W, JIANG B, MU W, et al. Production of d-allulose with d-psicose 3-epimerase expressed and displayed on the surface of Bacillus subtilis Spores[J]. JAgricFood Chem, 2016, 64(38): 7201-7207. |
| [31] |
NGUYEN Q A, SCHUMANN W. Use of IPTG-inducible promoters for anchoring recombinant proteins on the Bacillus subtilis spore surface[J]. Protein ExprPurif, 2014, 95(3): 67-76. |
| [32] |
CHEN H, ZHANG T, JIA J, et al. Expression and display of a novel thermostable esterase from Clostridium thermocellum on the surface of Bacillus subtilis using the CotB anchor protein[J]. Journal of Industrial Microbiology and Biotechnology, 2015, 42(11): 1439-1448. DOI:10.1007/s10295-015-1676-8 |
| [33] |
CHEN H, TIAN R, NI Z, et al. Surface display of the thermophilic lipase Tm1350 on the spore of Bacillus subtilis by the CotB anchor protein[J]. Extremophiles:Life Under Extreme Conditions, 2015, 19(4): 799-808. DOI:10.1007/s00792-015-0755-0 |
| [34] |
YUAN Y, FENG F, CHEN L, et al. Surface display of Acetobacter pasteurianus AdhA on Bacillus subtilis spores to enhance ethanol tolerance for liquor industrial potential[J]. European Food Research and Technology, 2014, 238(2): 285-293. DOI:10.1007/s00217-013-2100-0 |
| [35] |
TAVASSOLI S, HINC K, IWANICKI A, et al. Investigation of spore coat display of Bacillus subtilis β-galactosidase for developing of whole cell biocatalyst[J]. Archives of Microbiology, 2013, 195(3): 197-202. DOI:10.1007/s00203-013-0867-9 |
| [36] |
KWON S J, JUNG H C, PAN J G. Transgalactosylation in a water-solvent biphasic reaction system with-β-galactosidase displayed on the surfaces of Bacillus subtilis spores[J]. Applied and Environmental Microbiology, 2007, 73(7): 2251-2256. DOI:10.1128/AEM.01489-06 |
| [37] |
HWANG B Y, KIM B G, KIM J H. Bacterial surface display of a co-factor containing enzyme, ω-transaminase from Vibrio fluvialis using the Bacillus subtilis spore display system[J]. Bioscience, Biotechnology, and Biochemistry, 2011, 75(9): 1862-1865. DOI:10.1271/bbb.110307 |
| [38] |
KIM J H, LEE C S, KIM B G. Spore-displayed streptavidin:A live diagnostic tool in biotechnology[J]. Biochemical and Biophysical Research Communications, 2005, 331(1): 210-214. DOI:10.1016/j.bbrc.2005.03.144 |
| [39] |
ROSTAMI A, HINC K, GOSHADROU F, et al. Display of B.pumilus chitinase on the surface of B.subtilis spore as a potential biopesticide[J]. Pesticide Biochemistry and Physiology, 2017, 140: 17-23. DOI:10.1016/j.pestbp.2017.05.008 |
| [40] |
HUANG Z, LI G, ZHANG C, et al. A study on the effects of linker flexibility on acid phosphatase PhoC-GFP fusion protein using a novel linker library[J]. Enzyme and Microbial Technology, 2016, 83: 1-6. DOI:10.1016/j.enzmictec.2015.11.002 |
| [41] |
XU X, GAO C, ZHANG X, et al. Production of N-acetyl-D-neuraminic acid by use of an efficient spore surface display system[J]. Applied and Environmental Microbiology, 2011, 77(10): 3197-3201. DOI:10.1128/AEM.00151-11 |
 2018, Vol. 25
2018, Vol. 25 


