【研究意义】两面针药材为芸香科花椒属植物两面针Zanthoxylum nitidum (Roxb.)DC.的干燥根,有行气止痛、活血散瘀、通络祛风等作用,为广西主产药材之一,主要用于治疗跌打损伤、风湿痹痛、牙病、胃病、咽喉肿痛及毒蛇咬伤等症[1]。在广西民间,除法定的根部位入药外,两面针的叶也被广泛使用。因其疗效好,价值高,近年来两面针的使用范围不断拓宽,用量逐年增大,但因生长周期长,加上长期大量的采挖,致使两面针植物资源急剧锐减,目前两面针的野生蕴藏量(干质量)约为2 600吨[2]。研究如何充分利用现有的两面针植物资源意义重大。【前人研究进展】目前,两面针的研究大多集中在药用部位根和叶的挥发油化学成分活性方面[3-5],而对其果壳挥发油的提取与化学成分及活性的研究未见报道。本课题组研究发现,两面针的鲜果富含挥发油,水蒸气蒸馏法获得挥发油的得率为0.4%[6],其主要成分与已有文献[3-5]报道的根和叶部位的挥发油成分不同。【本研究切入点】为开发两面针新的药用部位,发掘新的活性成分,本研究对不同产地的两面针果壳进行挥发油提取。【拟解决的关键问题】运用GC-MS对两面针果壳挥发油化学成分进行分析,并进行抗肿瘤活性研究,拟为两面针的综合利用与开发提供科学依据。
1 材料与方法 1.1 仪器Agilent 7890B-5977A气相色谱-质谱联用仪、Agilent 7693A自动进样器、MassHunter质谱工作站、NIST 11版质谱数据库、CO2细胞培养箱(Thermo公司)、酶标仪(BioTek ELx800)。
1.2 材料两面针果实采集于广西灵山、玉林、马山等地,由广西中医药研究院中药资源研究所赖茂祥研究员鉴定为芸香科植物两面针Zanthoxylum nitidum (Roxb.)DC.的果实,果实阴干后去除果核,果壳备用。
DMEM培养基(Dulbecco's Modified Eagle Media)、胎牛血清(GIBCO公司);3-(4, 5-二甲基-2-噻唑基)-2, 5-二苯基-2H-四氮唑溴盐(MTT,MP Biomedicals公司)。
细胞株:宫颈癌细胞(Hela)、乳腺腺癌细胞(MCF-7)、肺腺癌细胞(A549)、胃癌细胞(MGC-803)、结肠癌细胞(COLO-205)菌株均为海南师范大学化学化工学院付艳辉副教授赠送。
1.3 方法 1.3.1 挥发油的提取称取干燥的两面针果壳适量,按2015版《中国药典》四部通则2204挥发油测定法提取挥发油,经无水硫酸钠脱水,即得无色澄清液体。
1.3.2 气相-质谱分析条件色谱条件:色谱柱Agilent HP-5Ms(30 m×250 μm×0.25 μm)毛细管柱;初始温度60℃,以2 ℃/min升温到180℃,再以5 ℃/min升温到210℃;进样量:0.2 μL;分流比:150:1;流速:0.8 mL/min;进样口温度:250℃;传输线温度:280℃;离子源温度:230℃;四级杆温度:150℃;EI源:电子能量70 eV;质量扫描范围(m/z)35~450 amu。
1.3.3 细胞毒性试验[7-9] 1.3.3.1 接种细胞用含10%胎牛血清的培养液(DMEM)配成单个细胞悬液,以每孔5 000个细胞接种到96孔板,每孔体积100 μL,贴壁细胞提前12 h接种培养。
1.3.3.2 挥发油介导精确称取两面针果壳挥发油,将其溶于0.01 mol/LPBS(制备方法:准确称量KCl 0.2 g、KH2PO4 0.2 g、NaCl 8.0 g、Na2HPO4·2H2O 1.56 g,各成分依次溶解于三蒸水中,在1 000 mL容量瓶中定容,分装消毒)中,使其终浓度为200 mg/mL后,以0.22 μm微孔滤膜滤过除菌,放置于-20℃保存备用。取两面针果壳挥发油储液,用DMEM完全培养基配置成梯度浓度(依次为200 μg/mL、100 μg/mL、50 μg/mL、25 μg/mL、12.5 μg/mL),取100 μL作用于细胞进行初筛,每孔终体积100 μL,每种处理均设6个复孔。再对肿瘤细胞生长抑制在50%附近的挥发油溶液设同样5个浓度进入梯度复筛。
1.3.3.3 显色37℃培养48 h后,每孔加MTT溶液20 μL。继续孵育4 h,终止培养,吸弃孔内培养上清液,每孔加150 μL的DMSO溶液,使结晶物充分融解。
1.3.3.4 比色选择490 nm波长,酶标仪读取各孔光吸收值,记录结果。计算挥发油溶液的IC50值。
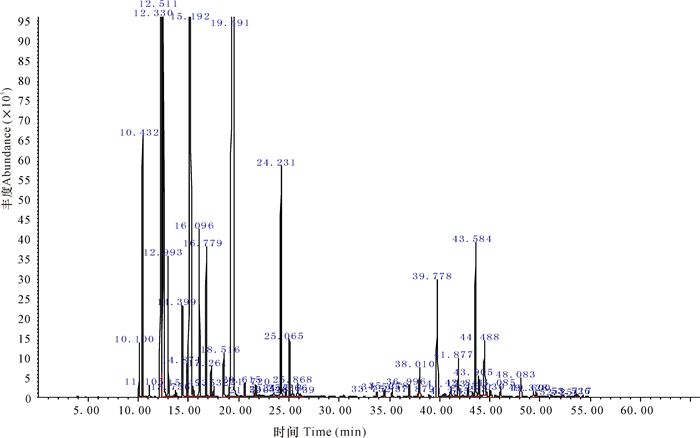
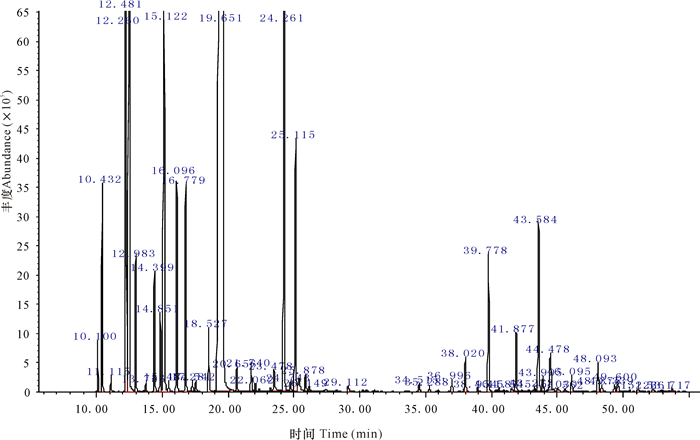
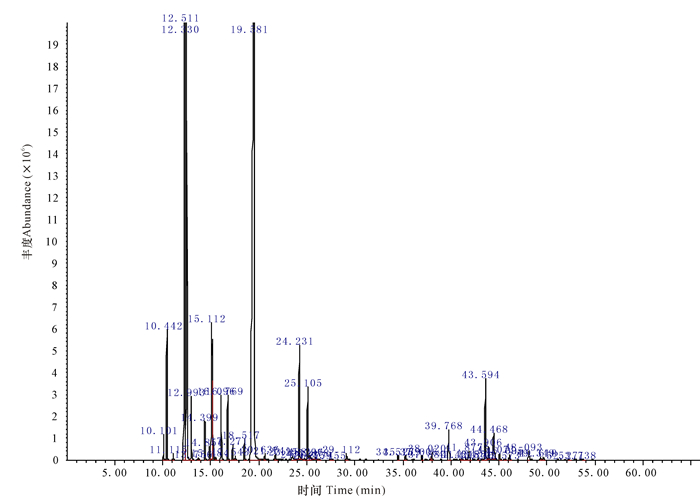
2 结果与分析 2.1 挥发油化学成分分析不同产地两面针果壳挥发油得率为0.5%~0.7%(mL/g)。从3个产地两面针果壳挥发油中共分离出41个峰(图 1~3),根据标准谱图库(NIST11)检索并按各色谱峰的质谱裂片图与文献核对,分别对各色谱峰进行确认,从而鉴定出大部分化学成分,并采用面积归一化法分别计算挥发油中各成分的峰面积相对百分比(表 1),所鉴定的组分峰面积之和占挥发油总色谱峰面积总和的90%以上。
|
图 1 灵山两面针果壳挥发油总离子流图 Fig.1 TIC of essentiol oils of Zanthoxylum nitidum (Roxb.) DC.from Lingshan |
|
图 2 马山两面针果壳挥发油总离子流图 Fig.2 TIC of essentiol oils of Zanthoxylum nitidum (Roxb.) DC.from Mashan |
|
图 3 玉林两面针果壳挥发油总离子流图 Fig.3 TIC of essential oils of Zanthoxylum nitidum (Roxb.)DC.from Yulin |
| 表 1 不同产地两面针果壳挥发油化学成分表 Table 1 Chemical constituents of Zanthoxylum nitidum (Roxb.)DC.from different regions |
图 1~3中灵山、马山、玉林3个产地两面针果壳的挥发油总离子流图相似,表明其主要化学成分相同,均含有芳樟醇、β-水芹烯、β-蒎烯、柠檬烯、1, 8-桉叶素等主要化学成分。采用面积归一化法对3个产地两面针果壳挥发油总离子流图中各主成分含量进行计算和比较,发现三者主要成分百分含量有一定的区别,灵山和玉林2个产地挥发油中的主要成分含量无显著性差别,但两者与马山采集的两面针果壳挥发油比较有较大的差异,主要体现在灵山和玉林采集的两面针果壳挥发油中芳樟醇含量为20%左右、β-水芹烯含量低于10%,而马山采集的两面针果壳挥发油中芳樟醇含量高达50%以上,β-水芹烯含量高于20%。
2.2 对细胞增殖的影响两面针果壳挥发油对宫颈癌细胞(Hela)、乳腺腺癌细胞(MCF-7)、肺腺癌细胞(A549)、胃癌细胞(MGC-803)、结肠癌细胞(COLO-205)的生长表现出一定的抑制作用,IC50值分别为54.37 μg/mL、58.23 μg/mL、62.59 μg/mL、56.78 μg/mL、78.56 μg/mL。由此可以初步认为两面针果壳挥发油具有一定的抗肿瘤活性,但其作用机制尚待进一步研究。
3 结论根据文献报道,两面针根挥发油主要成分为斯杷土烯醇、异斯杷土烯醇、异香树素环氧化物[3],而叶挥发油主要成分为橙花叔醇、δ-杜松醇、棕榈酸[4]。本研究结果表明两面针果壳挥发油的主要成分与根和叶不同,此外不同产地两面针果壳挥发油主成分含量也存在明显差异。灵山、马山和玉林3个产地中,灵山和玉林2个产地的两面针生长周期相同,马山采集的两面针生长周期较长,两面针药材通常在生长至4~5年后采集。因此,生长年限的不同可能为3个产地两面针果壳挥发油主要成分差异的主要因素。本研究通过对两面针果壳挥发油的分析鉴定,为其挥发油化学成分研究提供参考,还可为综合利用两面针以及研究开发两面针果实提供研究基础与科学依据。MTT实验结果表明,两面针果壳挥发油对宫颈癌细胞(Hela)、乳腺腺癌细胞(MCF-7)、肺腺癌细胞(A549)、胃癌细胞(MGC-803)、结肠癌细胞(COLO-205)具有较强的生长抑制作用,提示两面针果壳挥发油具有体外抗肿瘤活性作用,为两面针果壳的开发研究提供了研究方向。
| [1] |
国家药典委员会. 中华人民共和国药典:一部[M]. 北京: 中国医药科技出版社, 2015: 169. Chinese Pharmacopoeia Commission. Pharmacopoeia of the people's republic of china:Section 1[M]. Beijing: China Medical Science Press, 2015: 169. |
| [2] |
余丽莹. 中药材两面针种质资源的研究[D]. 北京: 中国协和医科大学, 2007. YU L Y. Studies on the germplasm of Zanthoxylum nitidum (Roxb. )DC. [D]. Beijing: Peking Union Medical College, 2007. http://cdmd.cnki.com.cn/Article/CDMD-10023-2009063856.htm |
| [3] |
李启发, 王晓玲, 官艳丽, 等. 两面针药材挥发油的GC-MS分析[J]. 天然产物研究与开发, 2006, 18: 69-71. LI Q F, WANG X L, GUAN Y L, et al. GC-MS analysis of essential oil from the roots of Zanthoxylum nitidum[J]. Nat Prod Res Dev, 2006, 18: 69-71. DOI:10.3969/j.issn.1001-6880.2006.01.018 |
| [4] |
VILAYSACK MACKHAPHONH (阿优), 冯洁, 李进英, 等. 不同采收期两面针叶挥发性成分的GC-MS分析[J]. 时珍国医国药, 2013, 24(5): 1244-1246. VILAYSACK MACKHAPHONH(A You), FENG J, LI J Y, et al. GC-MS analysis of essential oil from the leaves of different harvest periods of Zanthoxylum nitidum DC.[J]. Lishizhen Medicine and Materia Medica Research, 2013, 24(5): 1244-1246. |
| [5] |
周劲帆, 覃富景, 冯洁, 等. 两面针根挥发油的抗炎镇痛作用研究[J]. 时珍国医国药, 2012, 23(1): 19-20. ZHOU J F, QIN F J, FENG J, et al. Anti-inflammatory and analgesic activities of essential oil from the roots of Zanthoxylum nitidum DC.[J]. Lishizhen Medicine and Materia Medica Research, 2012, 23(1): 19-20. |
| [6] |
刘布鸣, 莫建光. 实用芳香精油图谱[M]. 南宁: 广西科学技术出版社, 2016. LIU B M, MO J G. Atlas of practical aromatic essential oil[M]. Nanning: Guangxi Science and Technology Press, 2016. |
| [7] |
梁乔芳, 刘华钢, 谭强, 等. 二去水卫矛醇对人脑肿瘤细胞体外抑制作用[J]. 广西科学, 2015(4): 454-456. LIANG Q F, LIU H G, TAN Q, et al. Inhibitory effect of 1, 2:5, 6-dianhydrogalctitol on human brain tumor cells in vitro[J]. Guangxi Sciences, 2015(4): 454-456. |
| [8] |
唐思丽, 王声, 孙明娜, 等. 莪术活性成分的分离鉴定及活性研究[J]. 中国现代中药, 2017(3): 354-357. TANG S L, WANG S, SUN M N, et al. Isolation, identification and activity assay of active ingredients of Rhizoma Curcumae[J]. Modem Chinese Medicine, 2017(3): 354-357. |
| [9] |
莫斯锐, 谢集照, 林霄, 等. 板蓝根组酸的分离与GC-MS分析和体外抗肿瘤活性研究[J]. 广东化工, 2017, 44(343): 13-15. MO S R, XIE J Z, LIN X, et al. Isolation and structural analysis on GC-MS and study on the antitumor activity in vitro of Banlangen-acids[J]. Guangdong Chemical Industry, 2017, 44(343): 13-15. |
 2018, Vol. 25
2018, Vol. 25 


