2. 广西国有东门林场,广西扶绥 532100
2. Dongmen State Forest Farm of Guangxi, Fusui, Guangxi, 532100, China
【研究意义】在全球气候变化背景下,为应对气候变化的需要,增加碳固存和减少碳排放成为人工林经营的重要内容,为此,人工林的适应性管理成为学术界关注的热点[1]。合理轮伐期是实现人工林适应性管理的主要影响因素之一。桉树短周期多代连栽导致立地生产力下降与轮伐期的选择密切相关,开展不同轮伐期对桉树人工林碳固存的影响研究,可为应对气候变化和提高人工林的适应性管理提供理论依据。【前人研究进展】目前,关于人工林碳固存的研究报道非常多[2-6],但对于桉树人工林的研究相对较少,大都是基于短轮伐状态下的固碳现状[7-9],而对经营管理措施的改变如何影响人工林碳固存缺乏深入研究[10]。【本研究切入点】根据经营目标的不同,全球桉树人工林的轮伐期大体上可分为短周期(5~7 a)、中周期(10~15 a)和长周期(20~25 a)[11-13]。本研究拟通过评估不同轮伐期对桉树人工林碳固存的影响,从应对气候变化的视角明确我国南亚热带地区桉树人工林的最佳轮伐期,为在全球气候变化背景下科学合理地制定桉树人工林的轮伐期提供科学依据。【拟解决的关键问题】以轮伐期为短(7 a)、中(13 a)和长周期(21 a)的巨尾桉人工林为研究对象,通过对不同轮伐期桉树林分生物量、碳固存、年平均固碳量的分析,揭示不同轮伐期对桉树林分碳固存的影响。
1 材料与方法 1.1 研究区域研究区域位于广西国有东门林场,居北纬22°17′22.30″、东经107°14′108.00″。该区域地处南亚热带,夏季高温多雨,冬季低温干燥,季风气候明显。区域内太阳辐射强烈,是广西太阳辐射高值区之一,年平均日照时数为1 634~1 719 h,太阳辐射量为439.64~452.20 kJ/(cm2·a);最冷月(1月)平均气温12.5~13.8℃,最热月(7月)平均气温27.2~28.6℃,年均气温为21.2~22.3℃,极端最高温38~41℃,极端最低温-4~1.9℃;年降雨量1 100~1 300 mm,季节分配不均,6~8月的降雨量可占全年降雨量的51%;年蒸发量为1 600 mm;相对湿度75%[14]。研究区域的土壤以赤红壤为主,兼有少量石灰土和红壤土。土层深厚,但质地粘重,肥力较差,有机质含量在12.08~24.51 g/kg,土壤呈酸性,pH值为5.0~5.5[14]。
1.2 样地概况采用空间代替时间的研究方法,在东门林场选择成土母质、环境因子(海拔、坡度、坡向等)、造林和营林措施、林下植被一致,林龄分别为7 a、13 a、21 a的巨尾桉人工林作为研究对象(表 1)。各林分均通过炼山、机耕全垦,穴植造林,株行距为2 m×3 m。各林分抚育管理措施一致,造林时施基肥,植苗后1~3 a追肥并喷施除草剂进行除草抚育,造林后第4年起停止施肥、喷施除草剂等人为干扰,均未遭受自然灾害及间伐。在各林龄的林分中随机设置面积为600 m2(30 m×20 m)的样方,每种林分设3次重复,将每个样方划分成6个10 m×10 m的小样方(共54个小样方)。
| 表 1 不同轮伐期巨尾桉人工林样地概况 Table 1 The basic situation of sample plots of Eucalyptus grandis×E.urophylla plantations in different rotations |
乔木层每木调查及生物量测定:在样地建好后,对样地内的所有林木进行每木调查,测定胸径和树高。每种林分采伐7~9株标准木,以收获法和相对生长法测定和计算林木和林分的生物量[15]。
灌木层生物量测定:在每个30 m×20 m大样方中随机设置3个面积为2 m×2 m的小样方,采用完全收获法测定灌木层生物量[15]。将灌木连根挖起,分为地上部分和地下部分,称取各部分鲜重后取各组分样品约500 g带回实验室,测定含水率。
草本层和枯枝落叶层生物量测定:在每个30 m×20 m大样方随机设置3个面积为1 m×1 m的小样方,采用完全收获法测定草本层和枯枝落叶层的生物量[15]。将小样方内所有草本植物和枯枝落叶全部收获,称鲜重后各取约500 g样品带回实验室,测定含水率。
1.4 土壤调查和样品采集在每个30 m×20 m大样方内按照“品”字形挖3个土壤剖面,分层采集0~20 cm、20~40 cm、40~60 cm土层的土壤样品,用四分法混合取样,将样品带回实验室进行室内分析。同时,用环刀取土样,测定各土层的土壤容重。
1.5 样品分析和测试植物样品经105℃杀青2 h后,于65℃恒温烘干至恒重。根据样品的干重和鲜重计算其含水率,进而计算各组分的生物量干重。将烘干样品研磨后,过100目筛,用于含碳率的测定。将各林分相同器官的样品制成混合样品,用四分法取样约10 g。灌木层、草本层、枯落物层的烘干样品经粉碎后,按各层地上、地下部分混合取样,用四分法取样约10 g。用元素分析仪(vario EL Ⅲ)测量植物和土壤的全碳含量。
1.6 数据统计分析利用胸径(D)作为自变量,各组分生物量为因变量,建立不同轮伐期巨尾桉人工林各组分(树干、树皮、树枝、树叶、根)的生物量和整株总生物量的回归方程[15];
生物量碳储量(Biomass carbon stock, BCS)=生物量×植物含碳率(%);
土壤有机碳储量(Soil organic carbon stock, SOCSi)=Pi×Ci×Di×(l-Si);
式中SOCSi为土壤i层单位面积总有机碳储量,Pi是第i土层土壤容重,Ci是第i土层的平均有机碳含量,Di是第i土层的厚度(cm),Si是第i土层的石砾含量;
地上部分生物量碳(Abore-ground biomass carbon stock, ABCS):指乔木层的树干、树皮、树枝、树叶以及灌木层、草本层、枯枝落叶层的固碳量;
地下部分生物量碳(Under-ground biomass carbon stock, UBCS):指地下根系(根蔸、粗根、中根和细根)的固碳量;
总生物量碳(TBCS):指地上生物量碳与地下生物量碳之和,TBCS=ABCS+UBCS;
土壤有机碳(SOC):指土壤有机质(通过微生物作用所形成的腐殖质、动植物残体和微生物体的总称)中的固碳量;
总固碳量(Total carbon stock, TCS):总生物量碳与土壤有机碳之和,TCS=TBCS+SOCS。
采用单因素方差分析法(one way ANOVE)检验不同轮伐期巨尾桉人工林的碳固存和碳固持能力等的差异。所有统计分析均在Excel 2007和SPSS 21.0上完成,采用最小显著性差异法(Least significant difference, LSD)比较在0.05水平下各项指标的差异显著性。数据绘图由Sigmaplot 11.0软件完成。
2 结果与分析 2.1 不同轮伐期林分的生物量 2.1.1 乔木层生物量由表 2中可以看出,以W=aDb模式对不同轮伐期巨尾桉林木各组分生物量进行拟合,其拟合精度很高,除了21 a轮伐期桉树树皮和叶的拟合为显著水平(P < 0.05)外,其他都达到了极显著水平(P < 0.01),可用于巨尾桉林木生物量估测。
| 表 2 巨尾桉林木生物量估算模型 Table 2 Biomass regression models of different tree components of E.grandis×E.urophylla plantations |
方差分析表明,不同轮伐期巨尾桉人工林乔木层各组分生物量以及总生物量存在显著差异(P < 0.05)(图 1)。在不同轮伐期的林分中,树干的生物量均为最大,在7 a、13 a、21 a轮伐期分别为(97.90±4.13) t/hm2、(265.23±26.55) t/hm2、(278.02±27.64) t/hm2,分别占总生物量的73.32%、79.13%、72.55%(图 1)。在7~13 a轮伐期,树干生物量增长量最大,达167.33 t/hm2,而在13~21 a阶段的增长量平缓,仅为12.79 t/hm2。树皮的生物量由7 a时的(7.21±0.29) t/hm2增至13 a时的(20.59±2.08) t/hm2,21 a时为(25.48±1.17) t/hm2,分别占总生物量的5.40%、6.14%、6.65%。在7 a、13 a、21 a轮伐期,树枝的生物量分别为(7.01±0.32) t/hm2、(11.81±1.18) t/hm2、(25.23±4.12)t/hm2,分别占总生物量的5.25%、3.52%、6.58%,在13~21 a阶段,枝生物量的增长量大于7~13 a阶段。在各轮伐期,叶的生物量占总生物量的比率最低,分别为2.3%、1.67%及1.14%。在7 a、13 a、21 a轮伐期,巨尾桉根的生物量分别为(18.34±0.76) t/hm2、(31.93±3.21) t/hm2、(50.09±7.09)t/hm2,分别占总生物量的13.74%、9.52%、13.07%,其生物量增长量在13~21 a期间(18.16 t/hm2)高于7~13 a期间。

|
不同大写字母表示差异显著 Different capital letters indicate significant difference 图 1 不同轮伐期巨尾桉人工林乔木层生物量 Fig.1 Biomass of different tree components of E.grandis×E.urophylla plantations in different rotations |
从表 3可以看出,灌木层地上部分和地下部分生物量随年龄的增长表现出先增后减的趋势。7 a轮伐期的灌木层地上部分生物量为(7.65±1.11) t/hm2,13 a轮伐期增长了几乎一倍,达到了(13.85±0.18) t/hm2,而后在21a轮伐期又降到(11.48±0.66)t/hm2,虽然生物量有所下降,但仍较7 a轮伐期的大,且差异显著(P < 0.05)。相反,灌木层地下部分生物量7 a轮伐期为(3.08±0.50) t/hm2,13 a轮伐期增长至(4.80±1.84) t/hm2,但在21 a轮伐期却降为(1.85±0.06) t/hm2。
| 表 3 不同轮伐期巨尾桉人工林林下地被层生物量 Table 3 Biomass of understory and litter layers of E.grandis×E.urophylla plantations in different rotations |
从表 3还可看出,3个轮伐期草本层地上部分、地下部分及其总和随轮伐期增长变化的规律一致,均表现为随着轮伐期的延长而增大,且地上部分的增长量最大。对比7 a和13 a轮伐期,21 a轮伐期的草本层地上部分生物量分别增加了1.05 t/hm2和6.59 t/hm2。草本层地下部分生物量随轮伐期延长的幅度不大,不同轮伐期林分间的差异不显著(P>0.05)。枯落物的生物量随轮伐期的延长呈现先增后减的趋势,但三者之间无显著差异(P>0.05)。
纵观不同轮伐期林下的生物量可发现,林下灌木层、草本层和枯落物层生物量的分布表现为7 a、13 a轮伐期灌木层>枯落物>草本层;21 a轮伐期灌木层>草本层>枯落物,灌木层生物量占据林下生物量的主要地位。13 a轮伐期的林下总生物量最大,但只比21 a轮伐期多了0.2 t/hm2,两者间差异不显著(P>0.05)。
2.2 不同轮伐期不同组分的碳含量由表 4可知,3个轮伐期巨尾桉不同组分的碳含量有所不同,但差异不显著(P >0.05)。树干和根的碳含量均随着轮伐期的延长呈现先增后减的趋势,在13 a轮伐期最高,21 a轮伐期最低。树皮和叶的碳含量则是随着轮伐期的延长而逐渐减小,但下降幅度均不大,分别下降了2.0%和0.89%。而枝的碳含量随着轮伐期的延长基本保持不变。在所有组分中,叶的平均碳含量最高,为(49.89±1.60)%,树皮的平均碳含量最小,为(44.44±1.67)% (表 4)。
| 表 4 不同轮伐期巨尾桉人工林乔木层各组分碳含量 Table 4 Carbon content of different tree component of E.grandis×E.urophylla plantations in different rotations |
表 5显示,灌木层和草本层地上、地下部分以及枯落物的碳含量都表现为随轮伐期的延长而逐渐减小,且7 a轮伐期各组分含碳量均显著高于13 a及21 a轮伐期。各轮伐期林下植被碳含量均表现为草本层地上部分>枯落物层>草本层地下部分>灌木层地上部分>灌木层地下部分。
| 表 5 不同轮伐期巨尾桉人工林林下植被和枯落物的碳含量 Table 5 Carbon content of understory and litter layers of E.grandis×E.urophylla plantations in different rotations |
由图 2可以看出,7 a、13 a、21 a 3个不同轮伐期巨尾桉人工林的总生物量碳分别为(75.81±5.12)t·C/hm2、(180.11±19.97) t·C/hm2、(192.08±16.50) t·C/hm2,13 a及21 a轮伐期的总生物量碳显著高于7 a轮伐期,而13 a和21 a轮伐期之间差异不显著(图 2)。其中,地上部分生物量碳与总生物量碳的相似,地下部分生物量碳为21 a轮伐期显著高于7 a和13 a轮伐期,13 a轮伐期显著高于7 a轮伐期。

|
不同大写字母表示差异显著 Different capital letters indicate significant difference 图 2 不同轮伐期巨尾桉人工林的总生物量碳 Fig.2 TBCS of E.grandis×E.urophylla plantations in different rotations |
由图 3可以看出,不同轮伐期巨尾桉人工林土壤碳含量均随着土层深度的加深而逐渐减小。7 a轮伐期的0~20 cm土层碳含量为14.29 g/kg,20~40 cm土壤碳含量为11.24 g/kg,比表层土低3.05 g/kg,40~60 cm土壤碳含量为8.78 g/kg,比0~20 cm减少5.51 g/kg,0~20 cm、20~40 cm土层土壤碳含量显著高于40~60 cm土层(P < 0.05)。13 a轮伐期的0~20 cm土层土壤碳含量比20~40 cm和40~60 cm的分别高4.33 g/kg和6.59 g/kg,3个土层碳含量差异显著(P < 0.05)。21 a轮伐期的0~20 cm土层含碳量分别比20~40 cm和40~60 cm高3.91 g/kg和5.64 g/kg,3个土层碳含量差异显著(P < 0.05)。对比同一土壤深度的土壤碳含量,在0~20 cm土层,7 a轮伐期的碳含量为14.29 g/kg,13 a轮伐期的是14.35 g/kg,与7 a轮伐期的相差不大,21 a轮伐期极显著降低,为12.25 g/kg(P < 0.05);不同轮伐期20~40 cm及40~60 cm土层土壤碳含量差异极显著(P < 0.05),随着轮伐期的延长而逐渐减小。
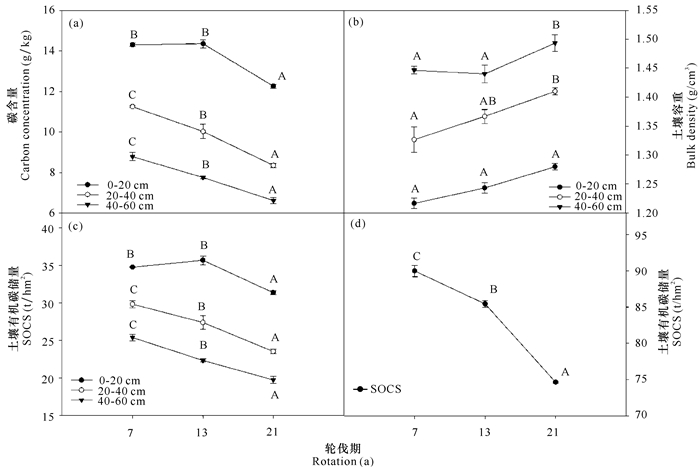
|
不同大写字母表示差异显著 Different capital letters indicate significant difference 图 3 不同轮伐期巨尾桉人工林土壤碳含量(a)、容重(b)及碳储量(c~d) Fig.3 Carbon concentration (a), bulk density (b), SOC stock at different soil depths (c) and total SOC storage (d) of E.grandis×E.urophylla plantations in different rotations |
不同轮伐期巨尾桉人工林土壤容重介于1.20~1.52 g/cm3(图 3b)。在0~20 cm、20~40 cm土层,土壤容重随着轮伐期的延长和土层深度的加深而逐渐增大;而在40~60 cm土层,土壤容重随着轮伐期的延长先减后增。不同轮伐期0~20 cm土层土壤容重差异不显著(P>0.05);20~40 cm土层,21 a轮伐期林地的土壤容重显著高于7 a轮伐期,13 a轮伐期的土壤容重介于两者之间,与两者差异均不显著;40~60 cm土层,21 a轮伐期林地的土壤容重显著高于7 a及13 a轮伐期的,而7 a及13 a轮伐期土壤容重差异不显著。
由图 3c可看出,0~20 cm土层土壤碳固存表现为先缓慢增加而后显著降低;20~40 cm、40~60 cm土层土壤碳固存则随轮伐期的延长而显著降低(图 3c)。7 a轮伐期0~20 cm、20~40 cm及40~60 cm土壤碳固存分别为(34.77±0.12) t·C/hm2、(29.83±0.81) t·C/hm2、(25.39±0.81) t·C/hm2;13 a轮伐期相应为(35.68±1.00) t·C/hm2、(27.39±1.56) t·C/hm2、(22.35±0.44) t·C/hm2;21 a轮伐期分别为(31.37±0.41) t·C/hm2、(23.53±0.53) t·C/hm2、(19.74±0.84) t·C/hm2。不同轮伐期巨尾桉人工林土壤总碳固存随轮伐期延长而显著降低(图 3d),7a轮伐期土壤总碳固存量为(89.99±0.35) t·C/hm2,13 a轮伐期为(85.42±0.76) t·C/hm2,21 a轮伐期为(74.64±0.24) t·C/hm2。
2.5 不同轮伐期林分的年平均固碳量如表 6所示,不同轮伐期巨尾桉人工林生物量碳和土壤有机碳的年平均固碳量变化规律是不同的。生物量碳的年平均固碳量是随着轮伐期的延长呈先增后减的变化趋势,而土壤有机碳的年平均固碳量则随着轮伐期的延长而持续降低。总固碳量的年平均固碳量与生物量碳的变化规律一致(表 6)。
| 表 6 不同轮伐期巨尾桉人工林的年平均固碳量 Table 6 Annual average carbon sequestration of E.grandis×E.urophylla plantations in different rotations |
生物量碳受到诸多因素的影响,在树种、气候、土壤和经营措施相同的条件下,轮伐期长短是一个重要的影响因素。研究表明长轮伐期有利于保持长期立地生产力,短轮伐期对森林生态系统的干扰频率较大,需要较长的恢复时间,易引起未来生产力的下降[10]。邢玮等[16]对杨树的研究表明,随着林分年龄的增长生物量碳逐渐增加,12 a、15 a和20 a林分的生物量碳分别为56.93 t·C/hm2、84.89 t·C/hm2和90.77 t·C/hm2。Ming等[17]对米老排(Mytilaria laosensis)人工林的研究发现,10 a、18 a、23 a米老排林的生物量碳分别是105.2 t·C/hm2、121.3 t·C/hm2和129.4 t·C/hm2。本研究与上述结果一致,巨尾桉人工林的总生物量碳也是随着轮伐期(年龄)的延长而逐渐增加,由7 a轮伐期的(75.81±5.12) t·C/hm2增至13 a轮伐的(180.11±19.97) t·C/hm2以及21 a轮伐期的(192.08±16.50) t·C/hm2,方差分析表明,只有13 a和21 a轮伐期的总生物量碳显著高于7 a轮伐期,而13 a和21 a轮伐期之间的差异不显著。这是由于轮伐期的延长,林分组成结构会不断变化,如胸径、树高、林下植被发育、凋落物等,轮伐期越长,生长周期越长,林分固碳量越高[10];13 a和21 a轮伐期之间的差异不显著,主要原因是随着年龄的增长,胸径和树高的增大,林木对水肥和光照的竞争加剧所致。
3.2 不同轮伐期对土壤有机碳的影响土壤有机碳受到许多因素的影响,如早期的土地利用、气候、土壤性质、森林类型、造林树种、林分年龄以及森林经营管理等[2-4, 18-19]。早期的研究表明,在造林后的几十年间,土壤有机碳会增加[20-22],而另一些研究发现土壤有机碳并非随着林分年龄的增加而增加[18-19, 23]。本研究表明,不同轮伐期巨尾桉人工林土壤总碳固存随轮伐期延长而显著降低,由7 a轮伐期的(89.99±0.35) t·C/hm2、13 a轮伐期的(85.42±0.76) t·C/hm2下降到21 a轮伐期的(74.64±0.24) t·C/hm2。桉树杂交种具有较长的速生期(>10 a),因此,在林分发育过程中需要更多的土壤养分。在本研究中,造林后第4年就不再进行施肥和林下抚育,导致土壤肥力下降、土壤容重增加和土壤有机碳含量的下降,因而,随着轮伐期的延长,土壤有机碳持续降低。枯落物层的碳固存虽然不高,但它是碳素从植被碳库向土壤碳库的转移主要途径,是土壤碳库中碳固存的主要来源[10]。在本研究中,随着轮伐期的延长,枯落物层的碳储量均呈下降趋势,可能也是导致土壤有机碳下降的原因。
3.3 不同轮伐期对年平均固碳量的影响年平均固碳量是反映林分固碳能力动态特征的重要指标。姚利辉等[24]认为,不同轮伐期的杉木林分的生物量碳和土壤有机碳随着轮伐期的延长不断降低,这与杉木林固碳动态特征不同有关;认为林分的固碳能力可分为5个阶段:固碳功能建立、固碳能力迅速增长、固碳能力最大、固碳能力相对平稳和固碳能力下降[24];不同的轮伐期对固碳动态特征有一定的影响,短轮伐期为固碳能力迅速增长的阶段,但由于林分分化过程尚未完成,林分竞争和凋落物较少等综合因素,对立地的消耗较为严重;而长轮伐期为固碳能力下降的过程,但由于凋落物积累和林下植被发育的影响,对立地的恢复较为有利[10, 24]。本研究表明,7~13 a仍是巨尾桉林分固碳能力迅速增长期,年平均总生物量碳由7 a时的(10.78±0.50)t·C/(hm2·a)迅速提高到13 a的(19.54±2.29)t·C/(hm2·a),增长81%;21 a时巨尾桉人工林进入固碳能力下降期,年平均总生物量碳降至(3.78±2.83)t·C/(hm2·a),固碳能力只是13 a的19.34%。巨尾桉人工林的年平均固碳量随着轮伐期的动态特征,除了与树种的固碳动态特征有关外,还与水肥条件和林分结构有关。为了延长巨尾桉人工林高的固碳能力,在林分生长后期加强培肥和林分结构化调控是重要的。
4 结论本研究结果表明,13 a和21 a轮伐期桉树人工林生物量碳储量显著高于7 a轮伐期。生物量碳储量是桉树人工林生态系统的最大碳库,13 a轮伐期桉树人工林生物量、生态系统年平均碳储量分别高达(19.54±2.29) t·C/(hm2·a)、(38.31±4.54)t·C/(hm2·a),均分别显著高于7 a轮伐期的(10.78±0.50) t·C/(hm2·a)和(34.41±1.10)t·C/(hm2·a)。从应对气候变化的视角出发,现行的7 a短轮伐期经营方式并非获得最佳固碳效果。而在21 a轮伐期中,桉树人工林生物量、生态系统年平均碳储量较13 a及7 a轮伐期已有显著下降,因此,在南亚热带,巨尾桉人工林的最佳轮伐期确定在13 a左右较为适宜,这与经济效益的最大化一致。
| [1] |
BRAVO F, LEMAY V, JANDL R, et al. 气候变化挑战下的森林生态系统经营管理[M]. 王小平, 杨晓晖, 刘晶岚, 等(译). 北京: 高等教育出版社, 2013. BRAVO F, LEMAY V, JANDL R, et al. Managing forest ecosystems: The challenge of climate change[M]. WANG X P, YANG X H, LIU J L, et al (Trans). Beijing: Higher Education Press, 2013. |
| [2] |
曹娟, 闫文德, 项文化, 等. 湖南会同3个林龄杉木人工林土壤碳、氮、磷化学计量特征[J]. 林业科学, 2015, 51(7): 1-8. CAO J, YAN W D, XIANG W H, et al. Stoichiometry characterization of soil C, N, and P of Chinese fir plantations at three different ages in Huitong, Hunan Province, China[J]. Scientia Silvae Sinicae, 2015, 51(7): 1-8. |
| [3] |
田晓, 刘苑秋, 魏晓华, 等. 模拟楠木杉木人工混交林不同混交比例对净生产力和碳储量的影响[J]. 江西农业大学学报, 2014, 36(1): 122-130. TIAN X, LIU Y Q, WEI X H, et al. Simulation of the effects of various mixing proportions on NPP and carbon storage in the mixedwood plantations of Phoebe bournei with Cunninghamia lanceolata[J]. Acta Agriculturae Universitatis Jiangxiensis, 2014, 36(1): 122-130. |
| [4] |
CAO J X, WANG X P, TIAN Y, et al. Pattern of carbon allocation across three different stages of stand development of a Chinese pine (Pinus tabulaeformis) forest[J]. Ecological Research, 2012, 27: 883-892. DOI:10.1007/s11284-012-0965-1 |
| [5] |
HARMON M E, MARKS B. Effects of silvicultural practices on carbon stores in Douglas-fir western hemlock forests in the Pacific Northwest, USA:Results from a simulation model[J]. Canadian Journal of Forest Research, 2002, 32: 863-877. DOI:10.1139/x01-216 |
| [6] |
LI X D, YI M J, SON Y, et al. Biomass and carbon storage in an age-sequence of Korean pine (Pinus koraiensis) plantation forests in central Korea[J]. Journal of Plant Biology, 2011, 54(1): 33-42. DOI:10.1007/s12374-010-9140-9 |
| [7] |
DU H, ZENG F P, PENG W X, et al. Carbon storage in a Eucalyptus plantation chronosequence in Southern China[J]. Forests, 2015, 6: 1763-1778. DOI:10.3390/f6061763 |
| [8] |
LI X, YE D, LIANG H, et al. Effects of successive rotation regimes on carbon stocks in Eucalyptus plantations in subtropical China measured over a full rotation[J]. PLoS One, 2015, 10(7): e0132858. DOI:10.1371/journal.pone.0132858 |
| [9] |
NGHIEM N. Optimal rotation age for carbon sequestration and biodiversity conservation in Vietnam[J]. Forest Policy and Economics, 2014, 38: 56-64. DOI:10.1016/j.forpol.2013.04.001 |
| [10] |
王伟峰, 段玉玺, 张立欣, 等. 不同轮伐期对杉木人工林碳固存的影响[J]. 植物生态学报, 2016, 40(7): 669-678. WANG W F, DUAN Y X, ZHANG L X, et al. Effects of different rotations on carbon sequestration in Chinese fir plantations[J]. Chinese Journal of Plant Ecology, 2016, 40(7): 669-678. DOI:10.17521/cjpe.2015.0407 |
| [11] |
温远光. 桉树生态、社会问题与科学发展[M]. 北京: 中国林业出版社, 2008. WEN Y G. Eucalyptus ecological, social issues and scientific development[M]. Beijing: China Forestry Publishing House, 2008. |
| [12] |
张国武, 罗建中, 尹国平. 澳大利亚·巴西桉树人工林经营特点及其启示[J]. 安徽农业科学, 2009, 37(7): 2965-2967. ZHANG G W, LUO J Z, YIN G P. Management feature of Eucalypt plantation in Australia and Brazil and its revelation[J]. Journal of Anhui Agri Sci, 2009, 37(7): 2965-2967. |
| [13] |
TURNBULL J W. Eucalypt plantations[M]//BOYLE J R, WINJUM J K, KAVANAGH K, et al (eds). Planted forests: Contributions to the quest for sustainable societies. Forestry sciences, 1999, 56: 37-52.
|
| [14] |
温远光, 左花, 朱宏光, 等. 连栽对桉树人工林植被盖度、物种多样性及功能群的影响[J]. 广西科学, 2014, 21(5): 463-468. WEN Y G, ZUO H, ZHU H G, et al. Effect of successive rotations on vegetation cover, species diversity and functional groups in Eucalypt plantations of South China[J]. Guangxi Sciences, 2014, 21(5): 463-468. |
| [15] |
刘世荣, 温远光. 杉木生产力生态学[M]. 北京: 气象出版社, 2005. LIU S R, WEN Y G. Productivity ecology of Chinese fir[M]. Beijing: China Meteorological Press, 2005. |
| [16] |
邢玮, 卜丹蓉, 葛之葳, 等. 不同林龄杨树人工林碳储量研究[J]. 生态科学, 2014, 33(1): 154-160. XING W, BU D R, GE Z W, et al. Study on carbon storage of poplar plantation at different stand ages[J]. Ecological Science, 2014, 33(1): 154-160. |
| [17] |
MING A, JIA H, ZHAO J, et al. Above-and below-ground carbon stocks in an indigenous tree (Mytilaria laosensis) plantation chronosequence in subtropical China[J]. PLoS One, 2014, 9(10): e109730. DOI:10.1371/journal.pone.0109730 |
| [18] |
PAUL K L, POLGLASE P J, NYAKUENGAMA J G, et al. Change in soil carbon following afforestation[J]. Forest Ecology and Management, 2002, 168(1/2/3): 241-257. |
| [19] |
PELTONIEMI M, MAKIPAA R, LISKI J, et al. Changes in soil carbon with stand age-an evaluation of a modelling method with empirical data[J]. Global Change Biology, 2004, 10: 2078-2091. DOI:10.1111/gcb.2004.10.issue-12 |
| [20] |
HOOKER T D, COMPTON J E. Forest ecosystem carbon and nitrogen accumulation during the first century after agricultural abandonment[J]. Ecological Applications, 2003, 13(2): 299-313. DOI:10.1890/1051-0761(2003)013[0299:FECANA]2.0.CO;2 |
| [21] |
PREGITZER K S, EUSKIRCHEN E S. Carbon cycling and storage in world forests:Biome patterns related to forest age[J]. Global Change Biology, 2004, 10: 2052-2077. DOI:10.1111/gcb.2004.10.issue-12 |
| [22] |
PEICHL M, ARAIN M A. Above-and belowground ecosystem biomass and carbon pools in an age-sequence of temperate pine plantation forests[J]. Agricultural and Forest Meteorology, 2006, 140(1/2/3/4): 51-63. |
| [23] |
RICHTER D D, MARKEWITZ D, TRUMBORE S E, et al. Rapid accumulation and turnover of soil carbon in a re-establishing forest[J]. Nature, 1999, 400: 56-58. DOI:10.1038/21867 |
| [24] |
姚利辉, 康文星, 赵仲辉, 等. 会同杉木人工林不同生长阶段植物固碳特征[J]. 生态学报, 2015, 35(4): 1187-1197. YAO L H, KANG W X, ZHAO Z H, et al. Carbon fixed characteristics of plant of Chinese fir (Cunninghamia lanceolata) plantation at different growth stages in Huitong[J]. Acta Ecologica Sinica, 2015, 35(4): 1187-1197. |
 2018, Vol. 25
2018, Vol. 25 


