【研究意义】广西是我国的海水养殖大省区,卵形鲳鲹(Trachinotus ovatus)是其重要的海水养殖经济鱼类。随着卵形鲳鲹需求量的不断攀升,近年来广西卵形鲳鲹的养殖业进入快速发展期,2016—2017年钦州、北海、防城港3地的卵形鲳鲹投苗量超过3亿尾,养殖效益极为显著,市场潜力巨大,有望成为继罗非鱼和对虾养殖后广西的又一大支柱性产业[1-3]。但值得注意的是,在持续几年的高密度“粗放式”养殖模式下,细菌、病毒、寄生虫等病害不断暴发,造成了巨大经济损失,制约着广西卵形鲳鲹养殖业的良性可持续发展[4-7]。探究养殖病害的致病机理,并研制出相应疫苗和抗病害的生物功能产品是从根本上解决和预防鱼类疾病的关键,而建立能够稳定传代的细胞系已成为研究病害感染机理、发展快速检测技术和研制疫苗的有效方法。【前人研究进展】从20世纪60年代发展至今,鱼类细胞培养已广泛应用于病毒学、基因组学、细胞生物学和环境毒理学等方面[8-9]。目前已经陆续建立一些针对各种海水鱼类的不同组织来源的细胞系[10-13]。但由于鱼类病害众多,养殖条件复杂多变,因此现有的海水鱼类细胞系种类仍显不足。据报道,一种严重的鱼类病毒性疾病—病毒性神经坏死病,近年来在华南地区的卵形鲳鲹养殖中频繁暴发,传染性极强,被该病毒感染的鱼苗死亡率高达100%[14-15]。由于其极高的传染性和危害性,病毒性神经坏死病被国际兽疫组织(OIE)列为重要的鱼类病害之一[16]。感染神经坏死病的鱼最典型的特征是急剧打转、弧状游动或螺旋等游动方式的失衡异常[14-15]。研究结果显示,负责鱼运动功能的是小脑,其位于脑的中部,前连中脑,后连延脑[17]。【本研究切入点】本研究采用胰蛋白酶消化法,建立卵形鲳鲹小脑来源的细胞系(Cell line from cerebellum of Trachinotus ovatus, TOCC),并对其生长速率、染色体核型、病原菌胞外产物对TOCC细胞的细胞毒性等进行分析。【拟解决的关键问题】 TOCC不仅能够用于广西卵形鲳鲹养殖中神经坏死病毒等疑似病害的分离和鉴定,而且在深入研究病害的侵染致病分子机理、动态监测环境污染和变化等方面具有广泛用途。
1 材料与方法 1.1 实验动物和细菌菌株卵形鲳鲹(Trachinotus ovatus)长约20 cm,采集自广西北海市铁山港近海网箱。本实验中所使用的病原菌为溶藻弧菌(Vibrio alginolyticus),从广西钦州湾网箱养殖的发病卵形鲳鲹中分离得到,保存于本实验室,编号为TOQZ01。
1.2 主要试剂和仪器0.25%胰蛋白酶(Trypsin)、青霉素-链霉素双抗混合液、Leibovitz’s L-15细胞培养基和胎牛血清(Fetal bovine serum, FBS)购自Gibco公司。组织漂洗液(含400 IU/mL双抗混合液的L-15培养基)、6孔细胞培养板、96孔细胞培养板和25 cm2培养瓶购自Corning公司,秋水仙素购自Sigma公司,细胞基因组DNA提取试剂盒购自Takara公司。原代细胞培养液(含400 IU/mL双抗混合液和20%FBS的L-15培养基)、传代细胞培养液(含10%FBS的L15培养基)、75%乙醇、细胞固定液(V甲醇:V冰醋酸=3:1)和LB液体培养基。
多功能酶标仪(Thermo, Multiskan FC)、无菌操作台(AIRTECH, SW-CJ-1FD)、倒置显微镜(Olympus, CX41)、激光共聚焦显微镜(Olympus, FV10i)、PCR仪(Eppendorf, Mastercycler nexus)、生化培养箱(博迅, SPX-100B-Z)、常温高速离心机(Eppendorf, 5424)和水浴锅(博迅, DK-8D)。
1.3 方法 1.3.1 细胞的原代培养采用胰蛋白酶消化法对卵形鲳鲹小脑来源的细胞进行原代培养。用75%乙醇对卵形鲳鲹进行体表消毒后剖开头部,剪取小脑组织块并用组织漂洗液漂洗3次。移去漂洗液,加入0.25%胰蛋白酶,用已灭菌的刀片将组织块切成碎块后室温静置消化30 min。消化后的细胞悬液用100目的灭菌滤网过滤至1.5 mL离心管中,100 g离心10 min后移除上清,将沉淀用原代细胞培养液重悬,接入25 cm2培养瓶中并置于28 ℃培养箱内培养。每3天按半量方式更换原代细胞培养液,至细胞铺满培养瓶的细胞培养面。
1.3.2 细胞的传代培养待原代细胞铺满培养瓶的细胞培养面后,进行传代培养。向培养瓶中加入1 mL 0.25%胰蛋白酶室温下消化1 min,加入培养液将细胞吹打混匀,然后将细胞悬液接入2个培养瓶中进行传代培养。
1.3.3 细胞系的18S rDNA基因测序分析细胞传代培养至25代时,按试剂盒上的步骤提取细胞的基因组DNA,作为PCR反应中的模板DNA。利用18S rDNA基因通用引物(5′-TACAGGACTCTTTCGAGGCCCTGT-3′、5′-CTTGCGCCGGTCCAAGAATTTCAC-3′)进行PCR扩增。PCR反应程序为:92℃预变性2 min,92℃变性1 min,55℃退火30 s,72℃延伸1 min,25个循环后72℃延伸10 min。将PCR产物样品交由上海生工生物工程服务有限公司测序,并进行Blast检索比对。
1.3.4 细胞系的染色体分析细胞传代培养至25代时,将细胞接入细胞培养瓶中培养48 h,加入秋水仙素(终浓度0.8 μg/mL)孵育4 h,用胰蛋白酶消化后100 g离心10 min收集细胞沉淀。接着将细胞重悬在75 mmol/L KCl溶液中37℃低渗处理30 min后,加入2 mL细胞固定液进行预固定。最后100 g离心10 min,将细胞再次重悬在细胞固定液中进行固定。本步骤重复3次。最后一次固定结束后,移除上清时留约300 μL固定液,将细胞吹打混匀,并于15 cm高处滴在预冷的载玻片上,将液滴吹散。室温晾干后用5%姬姆萨染液染色10 min,油镜下观察染色体形态,拍照并统计染色体数目。
1.3.5 细胞系的生长速率分析细胞传代培养至30代时,观察不同培养温度对细胞生长状态的影响,以确定小脑组织细胞系的最适生长温度。将细胞分别接种于6孔细胞培养板,分别在20℃、24℃、28℃、35℃培养。在培养的第1,3,5天用血球计数板进行细胞计数,统计卵形鲳鲹小脑组织细胞系在不同温度下的生长曲线。本实验重复做3次。
1.3.6 细胞系的毒性分析用病原性细菌溶藻弧菌的胞外产物对小脑组织细胞系进行毒性分析。把细菌接入LB液体培养基中37℃培养48 h后,将细菌稀释至1×108 cfu/mL的浓度,取1 mL菌液12 000 g 4℃离心30 min后收集上清,用0.22 μm滤柱过滤上清液后获得细菌胞外产物(ECPs),并且利用BCA蛋白检测试剂盒(Pierce Biotechnology, Rockford, IL)测定了上清液中细菌胞外产物(ECPs)中的蛋白含量。将细胞接入96孔细胞培养板,28℃培养24 h后,取ECPs(400 μg/mL)10 μL混匀在90 μL细胞培养液中,然后接入96孔细胞培养板的TOCC细胞中。无任何处理的正常细胞作为对照组(Con)。细胞继续培养24 h后在显微镜光镜下观察并拍照。为了检测ECPs对小脑组织细胞系的细胞毒性,向96孔细胞培养板的各孔细胞中加入20 μL能够检测细胞活性的试剂WST-8溶液,继续培养4 h后用酶标仪检测450 nm处的吸光度。本实验重复做3次。
2 结果与分析 2.1 卵形鲳鲹小脑来源细胞的原代培养与传代培养取卵形鲳鲹小脑组织,采用胰蛋白酶消化法对其进行原代培养,第2天可观察到细胞在培养瓶中贴壁,培养至第8天时细胞贴满培养瓶的细胞培养面,随后进行传代培养。在细胞生长初期,具有上皮样和成纤维样2种细胞类型(图 1a),随着细胞传代次数的增加,到第30代时,约95%以上的细胞为成纤维样细胞(图 1b)。目前该卵形鲳鲹小脑来源细胞系已传至40代,将其命名为卵形鲳鲹小脑细胞系(Cell line from cerebellum of Trachinotus ovatus, TOCC)。

|
图 1 卵形鲳鲹小脑来源细胞系的细胞形态 Fig.1 Morphology of TOCC |
将TOCC细胞的总DNA用18S rDNA引物进行PCR扩增,PCR产物交由上海生工生物工程服务有限公司测序。PCR产物的测序结果显示该条带大小为455 bp (图 2)。使用NCBI的BLAST功能对测序结果进行比对分析,结果显示TOCC的18S rDNA基因与卵形鲳鲹相一致,因此证实TOCC来源于卵形鲳鲹。

|
图 2 TOCC的18S rDNA基因测序结果 Fig.2 The partial 18S rDNA gene analysis results of TOCC |
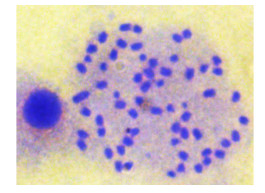
TOCC细胞传代培养至25代时,对其染色体核型进行观察分析,结果表明TOCC细胞染色体为圆柱形,数目为62条(图 3)。
|
图 3 第25代TOCC的染色体数目 Fig.3 Chromosome morphology of the 25th passage TOCC |
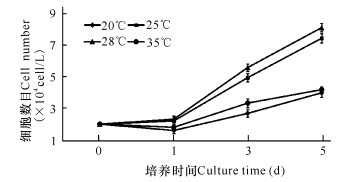
TOCC细胞传代培养至30代时,将细胞在不同温度下进行培养,结果显示TOCC在20℃和35℃生长比较慢,在25℃和28℃生长速度较快,其中28℃生长速度最快,因此证实TOCC的最适生长温度为28℃(图 4)。
|
图 4 TOCC的生长速率 Fig.4 The growth velocity of TOCC |
病原菌(溶藻弧菌)的胞外产物(ECPs)对TOCC细胞具有毒性,具体表现为TOCC细胞变圆、缩水并且从培养瓶的细胞培养面上脱落下来(图 5a)。细胞活性检测试剂WST-8的检测结果显示,与对照组相比,ECPs处理后的TOCC细胞活力显著降低(图 5b)。

|
图 5 溶藻弧菌胞外产物对TOCC的细胞毒性 Fig.5 Cytotoxicity of ECPs from Vibrio alginolyticus for TOCC |
近年来各种鱼类疾病频繁暴发,不仅给我国的水产养殖业造成巨大损失,也威胁到野生水生动物的生存。鱼类细胞系在鱼类病毒的分离、鉴定和病害侵染致病的分子机理研究中具有十分重要的作用。同时,由于体外毒性实验能够显著降低环境中致病微生物的评估时间,建立鱼类细胞系能够为评估细菌性病原的代谢产物对养殖鱼类的毒性提供有效的监测手段。卵形鲳鲹是广西重要的海水经济鱼类,近年来常常遭受到各种病原的危害,但是已建立的卵形鲳鲹细胞系十分有限 。本文采用胰蛋白酶消化法,建立了一株来自卵形鲳鲹小脑组织的细胞系,命名为TOCC,并对其细胞类型、核型分析、生长特性、细菌胞外产物细胞毒性测定等基本特征进行了分析。
最初建成培养的广西卵形鲳鲹小脑细胞系TOCC中分别具有上皮样和成纤维样2种细胞类型,经过连续传代后,成纤维样细胞成为主要形态。与TOCC类似的细胞形态上的变化,与已报道的一些鱼类细胞系相似,包括青石斑鱼肝脏、肾脏组织来源的细胞系[12-13],鳜鱼幼鱼细胞系[18],卵形鲳鲹肾脏和头肾组织来源的细胞系等[19-20]。
染色体核型是鱼类细胞系重要的生物学特征之一。对TOCC进行核型分析,结果显示TOCC的特征性染色体数目为62条,而已报道的卵形鲳鲹吻组织细胞系和肾脏组织细胞系的染色体数目是54条[19-21],这可能是因为来自于同种鱼类不同组织的细胞系,其染色体数目可能存在一定的异质性。这种现象在其他海水鱼类不同组织来源的细胞系上也有被发现[13, 21]。例如,青石斑鱼肾脏组织来源的细胞系、肝脏组织来源的细胞系、赤点石斑鱼脾脏组织来源细胞系及鳔细胞系的染色体数目分别为60条、76条、88条和72条[13, 22]。
TOCC细胞在不同温度下的生长情况显示,其最适生长温度为25~28℃,这与其他已建立的热带海水鱼类细胞系的生长温度相一致[10-13, 19-22]。TOCC细胞在20~28℃均可生长,根据现有报道,养殖病害通常在春夏和夏秋交接之际、水温20~30℃时易于暴发,因此可利用TOCC细胞分离不同感染温度下的鱼类病毒[4-7]。病原细菌在感染鱼体和增殖过程会通过向胞外释放代谢产物(细菌毒素)来干扰或破坏鱼体正常新陈代谢,并造成严重的细胞和组织损伤,因此评估病原细菌胞外产物的毒性对于研究病原菌的致病性极为重要[23]。传统上评估病菌胞外产物毒性的方法是在活体水平检测鱼的半数致死率(LC50),但这种方法不仅操作繁琐,而且耗时。本研究利用TOCC细胞替代传统的活体半数致死率测定方法对细菌胞外产物的毒性进行了分析,结果显示正常生长状态下长梭形的TOCC细胞变圆、皱缩,并且从培养瓶的细胞培养面上脱落下来,无法继续贴壁生长。细胞活性检测结果证实,细菌胞外产物(ECPs)对TOCC细胞具有明显的细胞毒性。鉴于体外毒性实验能够极大地减少针对环境中致病病原的检测评估时间,因此建立卵形鲳鲹小脑来源的TOCC为检测海水养殖中病害侵染和环境污染物的细胞毒性提供了可能,有望发展成为检测环境中有害物质的有效手段,但是需要进一步核实细胞系结果与活体试验的相关性。未来研究中,我们将利用TOCC开展广西卵形鲳鲹养殖中病毒性病害的分离和鉴定,并对病毒性病害的侵染机制和致病机理进行深入研究,进而开发出如疫苗等免疫功能产品和病害快速检测技术[24-27]。
4 结论本研究采用胰蛋白酶消化法分离得到卵形鲳鲹小脑组织的原代细胞,并进行原代培养和传代培养,将稳定传至40代的卵形鲳鲹小脑来源细胞系命名为卵形鲳鲹小脑细胞系(TOCC), 并对其细胞类型、核型分析、生长特性等生物学特征进行了研究分析。细菌胞外产物对TOCC的细胞毒性实验表明,该细胞系为替代活体试验检测细胞毒性提供了可能,而且为体外监测环境中病原和污染物提供了条件。
| [1] |
李坚明. "十三五"广西水产养殖业发展战略研究[J]. 中国渔业经济, 2016, 34(4): 25-31. LI J M. Research on development strategy of Guangxi aquaculture in 13th Five-Year[J]. Chinese Fisheries Economics, 2016, 34(4): 25-31. |
| [2] |
刘锡强, 马学坤, 刘康, 等. 华南地区金鲳鱼养殖报告[J]. 当代水产, 2014(2): 26-29. LIU X Q, MA X K, LIU K, et al. Reports on the cultured Trachinotus ovatus in South China[J]. Current Fisheries, 2014(2): 26-29. |
| [3] |
张少峰, 张春华, 邢素坤. 广西海洋经济发展现状与对策分析[J]. 海洋开发与管理, 2015(4): 103-106. ZHANG S F, ZHANG C H, XING S K. Analysis on the current situation and countermeasures of marine economic development in Guangxi[J]. Ocean Development and Management, 2015(4): 103-106. |
| [4] |
夏立群, 黄郁葱, 鲁义善. 卵形鲳鲹主要病害及其研究进展[J]. 安徽农学通报, 2012, 18(23): 140-143, 150. XIA L Q, HUANG Y C, LU Y S. The diseases in Trachinotus ovatus culture and their research progress[J]. Anhui Agricultural Science Bulletin, 2012, 18(23): 140-143, 150. DOI:10.3969/j.issn.1007-7731.2012.23.065 |
| [5] |
崔婧, 范雪亭, 刘文竹, 等. 华南地区海水养殖鱼类主要弧菌病原的分离与鉴定[J]. 海南大学学报:自然科学版, 2014, 32(3): 244-251. CUI J, FAN X T, LIU W Z, et al. Isolation and identification of Vibriosis pathogens of marine cultured fishes in Southern China[J]. Natural Science Journal of Hainan University, 2014, 32(3): 244-251. |
| [6] |
陈傅晓, 唐贤明, 谭围, 等. 卵形鲳鲹深水网箱养殖风险对策分析[J]. 中国渔业经济, 2011, 29(4): 145-150. CHEN F X, TANG X M, TAN W, et al. The wave-resisted deep-water net-cage breeding of Trachinotus ovatus for risk prevention countermeasures and economic benefit analysis[J]. Chinese Fisheries Economics, 2011, 29(4): 145-150. |
| [7] |
许海东, 区又君, 郭志勋, 等. 神经坏死病毒对卵形鲳鲹的致病性及外壳蛋白基因序列分析[J]. 上海海洋大学学报, 2010, 19(4): 482-488. XU H D, OU Y J, GUO Z X, et al. The pathogenicity of nervous necrosis virus to Trachinotus ovatus and sequence analysis of the coat protein gene[J]. Journal of Shanghai Ocean University, 2010, 19(4): 482-488. |
| [8] |
OUYANG Z L, HUANG X H, HUANG E Y, et al. Establishment and characterization of a new marine fish cell line derived from red-spotted grouper Epinephelus akaara[J]. Journal of Fish Biology, 2010, 77(5): 1083-1095. DOI:10.1111/jfb.2010.77.issue-5 |
| [9] |
QIN Q W, CHANG S F, NGOH-LIM G H, et al. Characterization of a novel ranavirus isolated from grouper Epinephelus tauvina[J]. Dis Aquat Organ, 2003, 53(1): 1-9. |
| [10] |
LEE M H, LOH P C. Some properties of an established fish cell line from the marine fish, Caranx mate(Omaka)[J]. Proc Soc Exp Biol Med, 1975, 150(1): 40-48. DOI:10.3181/00379727-150-38970 |
| [11] |
HUANG X H, HUANG Y H, OUYANG Z L, et al. Establishment of a cell line from the brain of grouper (Epinephelus akaara) for cytotoxicity testing and virus pathogenesis[J]. Aquaculture, 2011, 311: 65-73. DOI:10.1016/j.aquaculture.2010.11.037 |
| [12] |
LAI Y S, JOHN J A, LIN C H, et al. Establishment of cell lines from a tropical grouper, Epinephelus awoara (Temminck & Schlegel), and their susceptibility to grouper irido-and nodaviruses[J]. J Fish Dis, 2003, 26(1): 31-42. DOI:10.1046/j.1365-2761.2003.00434.x |
| [13] |
LAI Y S, MURALI S, JU H Y, et al. Two iridovirus-susceptible cell lines established front kidney and liver of grouper, Epinephelus awoara (Temminck & Schlegel), and partial characterization of grouper iridovirus[J]. Journal of Fish Diseases, 2000, 23(6): 379-388. DOI:10.1046/j.1365-2761.2000.00247.x |
| [14] |
蔡小辉, 文雪, 徐力文, 等. 卵形鲳鲹一例疑似神经性病毒病的初步分析[J]. 水产科学, 2012, 31(10): 597-601. CAI X H, WEN X, XU L W, et al. The suspected virus disease diagnose of juvenile ovate pompano Trachinotus ovatus cultured in cages[J]. Fisheries Science, 2012, 31(10): 597-601. DOI:10.3969/j.issn.1003-1111.2012.10.006 |
| [15] |
周永灿, 朱传化, 张本, 等. 卵形鲳鲹大规模死亡的病原及其防治[J]. 海洋科学, 2001, 25(4): 40-44. ZHOU Y C, ZHU C H, ZHANG B, et al. Isolation and prevention of the pathogen causing large scale death on Trachinotus ovatus[J]. Marine Sciences, 2001, 25(4): 40-44. |
| [16] |
ZHOU L, LI P, YANG M, et al. Generation and characterization of novel DNA aptamers against coat protein of grouper nervous necrosis virus (GNNV) with antiviral activities and delivery potential in grouper cells[J]. Antiviral Research, 2016, 129: 104-114. DOI:10.1016/j.antiviral.2016.02.009 |
| [17] |
谢从新. 鱼类学[M]. 北京: 中国农业出版社, 2010: 114. XIE C X. Ichthyology[M]. Beijing: China Agriculture Press, 2010: 114. |
| [18] |
DONG C F, WENG S P, SHI X J, et al. Development of a mandarin fish Siniperca chuatsi fry cell line suitable for the study of infectious spleen and kidney necrosis virus (ISKNV)[J]. Virus Research, 2008, 135(2): 273-281. DOI:10.1016/j.virusres.2008.04.004 |
| [19] |
ZHOU L L, LI P F, LIU J X, et al. Establishment and characterization of a mid-kidney cell line derived from golden pompano Trachinotus ovatus, a new cell model for virus pathogenesis and toxicology studies[J]. In Vitro Cell Dev Biol Anim, 2017, 53(4): 320-327. DOI:10.1007/s11626-016-0112-3 |
| [20] |
LI P, ZHOU L, WEI S, et al. Establishment and characterization of a cell line from the head kidney of Golden pompano (Trachinotus ovatus), and its application in toxicology and virus susceptibility[J]. J Fish Biol, 2017, 90(5): 1944-1959. DOI:10.1111/jfb.2017.90.issue-5 |
| [21] |
HUANG X H, HUANG Y H, SUN J J, et al. Characterization of two grouper Epinephelus akaara cell lines:Application to studies of Singapore grouper iridovirus (SGIV) propagation and virus-host interaction[J]. Aquaculture, 2009, 292: 172-179. DOI:10.1016/j.aquaculture.2009.04.019 |
| [22] |
YU Y, WEI S, WANG Z, et al. Establishment of a new cell line from the snout tissue of golden pompano Trachinotus ovatus, and its application in virus susceptibility[J]. J Fish Bio, 2016, 88(6): 2251-2262. DOI:10.1111/jfb.2016.88.issue-6 |
| [23] |
赖迎迢, 陶家发, 孙承文, 等. 鱼源溶藻弧菌生物学特性和病理组织学观察[J]. 微生物学报, 2014, 54(11): 1378-1384. LAI Y T, TAO J F, SUN C W, et al. Biological characteristics and histopathological observation of Vibrio alginolyticus from diseased fish[J]. Acta Microbiologica Sinica, 2014, 54(11): 1378-1384. |
| [24] |
LI P F, YU Q, ZHOU L L, et al. Probing and characterizing the high specific sequences of ssDNA aptamer against SGIV-infected cells[J]. Virus Research, 2018, 246: 46-54. DOI:10.1016/j.virusres.2018.01.006 |
| [25] |
LI P F, ZHOU L L, WEI J G, et al. Development and characterization of aptamer-based enzyme-linked apta-sorbent assay for the detection of Singapore grouper iridovirus infection[J]. J Appl Microbiol, 2016, 121(3): 634-643. DOI:10.1111/jam.2016.121.issue-3 |
| [26] |
ZHOU L, LI P, NI S, et al. Rapid and sensitive detection of redspotted grouper nervous necrosis virus (RGNNV) infection by aptamer-coat protein-aptamer sandwich enzyme-linked apta-sorbent assay (ELASA)[J]. J Fish Dis, 2017, 40(12): 1831-1838. DOI:10.1111/jfd.2017.40.issue-12 |
| [27] |
LI P, WEI S, ZHOU L, et al. Selection and characterization of novel DNA aptamers specifically recognized by Singapore grouper iridovirus-infected fish cells[J]. J Gen Virol, 2015, 96: 3348-3359. DOI:10.1099/jgv.0.000270 |
 2018, Vol. 25
2018, Vol. 25 


