2. 华南农业大学海洋学院,广东广州 510642
2. College of Marine Sciences, South China Agricultural University, Guangzhou, Guangdong, 510642, China
【研究意义】石斑鱼(Epinephelus tauvina)肉质细腻,营养丰富,作为我国大宗名贵海水养殖鱼类,在活海鲜市场中的经济价值极高。随着市场需求量的不断增加,我国石斑鱼养殖业进入快速发展期,养殖规模不断扩大,养殖效益持续增加,目前国内石斑鱼养殖年产量已达10万吨以上,产业直接产值超过百亿元[1]。但是随着石斑鱼养殖业的迅猛发展,石斑鱼的养殖密度不断加大,导致石斑鱼病害大规模暴发,其中石斑鱼虹彩病毒(Singapore grouper iridovirus, SGIV)的危害尤为严重,其致死率可高达90%以上,重创了我国的石斑鱼养殖业[2-4]。石斑鱼虹彩病毒作为一种高致病性的鱼类传染性病毒,在极短时间内会导致鱼大量死亡,因此研发可以快速、便捷检测虹彩病毒感染的诊断技术,对于控制SGIV感染、降低损失至关重要[5]。【前人研究进展】目前针对石斑鱼虹彩病毒发展出的检测方法,主要包括基于病毒学、组织病理学等传统观察法,基于分子生物学的PCR技术,以及基于抗体的免疫学检测法等[6-9]。虽然这些方法灵敏度和精确度比较高,但是存在操作繁琐、仪器昂贵、检测耗时长,以及试剂保存条件苛刻等种种不足,导致仅适用于实验室条件下小规模检测,无法满足对石斑鱼虹彩病毒病快速、准确检测诊断的要求,因此应着力发展操作便捷、成本低、耗时短、准确度高的新型的石斑鱼虹彩病毒病快速检测诊断技术[5]。指数富集配基系统进化(System evolution of ligands by exponential enrichment, SELEX)技术是一种前沿的生物文库筛选技术,该技术使用容量高达1014~1015的随机寡核苷酸文库,在体外经过多轮筛选最终获得能够特异性识别靶物质的单链寡核苷酸,即核酸适配体[10]。核酸适配体具有易筛选获得,成本低,易修饰,稳定性强,批次间质量相同,高特异性识别并结合靶物质等诸多优点[11-15]。【本研究切入点】在先前的研究中,我们基于细胞-指数富集配基系统进化技术(Cell-SELEX),以被虹彩病毒感染的石斑鱼脾细胞(GS)为靶标进行Cell-SELEX筛选,获得了高特异性的识别SGIV感染的核酸适配体[4]。【拟解决的关键问题】本研究基于核酸适配体(Q2)就石斑鱼虹彩病毒病的快速检测诊断技术进行系统研究,开发出一种新型的核酸适配体-荧光分子检测探针(Aptamer Q2-based fluorescent molecular probe,Q2-AFMP),并对Q2-AFMP检测石斑鱼虹彩病毒感染的特异性、灵敏性和稳定性进行分析研究。
1 材料与方法 1.1 材料本实验中所使用的石斑鱼虹彩病毒(SGIV, strain A3/12/98)来自于患病的石斑鱼(Epinephelus tauvina),由Qin等[2]于2003年首次分离鉴定得到;细胞培养瓶和24孔板、96孔板购自康宁公司;胎牛血清(Fetal bovine serum, FBS)购自GIBCO公司;异硫氰酸荧光素(Fluorescein isothiocyanate, FITC)标记的核酸适配体Q2(FITC-Q2)和FITC标记的非特异性单链核酸文库(FITC-ssDNA Library)由上海生工合成;本实验使用的仪器包括多功能酶标仪、无菌操作台、倒置显微镜、尼康荧光显微镜、PCR仪、生化培养箱、常温低速离心机、低温高速离心机、水浴锅。
1.2 方法 1.2.1 SGIV感染细胞的准备与处理在细胞培养瓶中培养石斑鱼脾细胞(GS)至基本铺满细胞培养瓶底面,在实验组细胞中加入SGIV,对照组的正常GS不作任何处理,继续培养48 h,将实验组和对照组中的细胞用磷酸缓冲盐溶液PBS (2 mmol/L KH2PO4,10 mmol/L Na2HPO4,137 mmol/L NaCl,pH值为7.2)轻轻洗涤3~5次后备用。
1.2.2 Q2-AFMP检测SGIV感染的操作流程Q2-AFMP的操作方法参考先前的报道[4],并进行了优化改进。具体步骤:将异硫氰酸荧光素(FITC)标记的核酸适配体Q2(FITC-Q2)在92℃高温水浴变性10 min,然后迅速插入到冰中复性10 min;将FITC-Q2(200 nmol/L)与待测细胞在室温结合30 min,然后用磷酸缓冲盐溶液PBS(pH值为7.2)1 000 g离心清洗3次,移除上清,将沉淀的样品重悬在200 μL磷酸缓冲盐溶液PBS(pH值为7.2)中,取30 μL重悬的样品滴在预冷的载玻片上并用盖玻片覆盖,然后在荧光显微镜下观察。将重悬的样品在92℃高温水浴处理5 min,5 000 g离心后取上清,使用多功能酶标仪读取待测样品在495/535 nm处的荧光值并记录结果。每个反应均做3个重复。
1.2.3 Q2-AFMP检测SGIV感染的特异性分析将异硫氰酸荧光素(FITC)标记的核酸适配体Q2(FITC-Q2, 200 nmol/L)经过92℃恒温水浴、冰浴处理;实验组为FITC-Q2(200 nmol/L)与SGIV感染的细胞孵育结合,对照组设置4组:Con1,FITC-Q2(200 nmol/L)与正常细胞孵育结合;Con2,FITC-ssDNA Library与SGIV感染的细胞孵育结合;Con3,FITC-Q2(200 nmol/L)与中华鳖虹彩病毒STIV感染的细胞孵育结合;Con4,未作其它处理的SGIV感染的细胞。孵育结合完成后,将各组样品用PBS离心清洗3次,后续的检测步骤参看1.2.2节。每个反应均做3个重复。
1.2.4 Q2-AFMP检测SGIV感染细胞的数量灵敏性分析将SGIV感染的细胞稀释至不同的数量:1×106个/mL,1×105个/mL,1×104个/mL,5×103个/mL,1×103个/mL;然后将FITC-Q2与SGIV感染的细胞在室温结合30 min。FITC-ssDNA Library与相应不同数目的SGIV感染细胞的孵育结合作为对照(Lib)。后续具体的检测操作参看1.2.2节。每个反应均做3个重复。
1.2.5 Q2-AFMP检测SGIV感染的时间灵敏性分析将FITC-Q2与SGIV感染的细胞在室温分别结合60 min,40 min,20 min,10 min,5 min和1 min。FITC-ssDNA Library与SGIV感染的细胞孵育结合相应时长的实验作为对照(Lib)。后续具体的检测操作参看1.2.2节。每个反应均做3个重复。
1.2.6 Q2-AFMP检测SGIV感染的稳定性分析将FITC-Q2与SGIV感染的细胞分别在冰上(Ice)、4℃、28℃、37℃和50℃孵育结合。FITC-ssDNA Library与SGIV感染的细胞在相应温度下的孵育结合作为对照。后续具体的检测操作参看1.2.2节。每个反应均做3个重复。
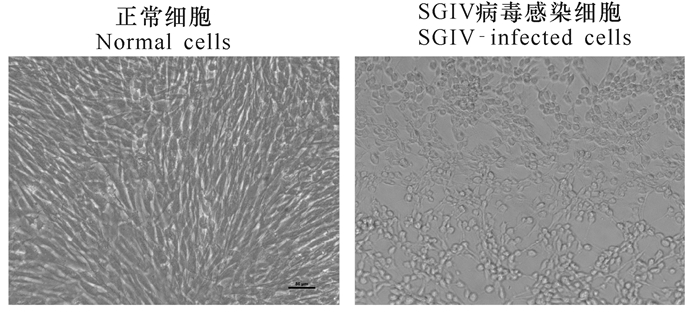
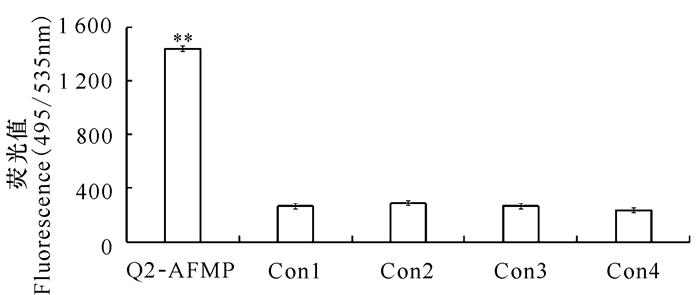
2 结果与分析 2.1 Q2-AFMP及其检测SGIV感染的特异性在先前研究中,基于前沿的指数富集配基系统进化技术(SELEX)筛选获得特异性识别SGIV感染的核酸适配体aptamer Q2,Q2的序列如表 1所示[4]。如图 1所示,与对照组中正常细胞相比,实验组中细胞接入SGIV继续培养48 h后,出现明显的细胞病变(Cytopathic effects, CPEs)。使用Q2-AFMP对实验组中SGIV感染细胞进行检测发现,与4组对照组相比,酶标仪检测结果显示Q2-AFMP能够特异性地检测SGIV的感染(图 2)。由此证明,Q2-AFMP能够用于海水养殖中石斑鱼虹彩病毒病的特异性检测。
| 表 1 核酸适配体-荧光分子检测探针(Q2-AFMP)中核酸适配体Q2的核苷酸序列 Table 1 The aptamer sequences of Q2 used in Q2-AFMP |
|
图 1 石斑鱼细胞被虹彩病毒SGIV感染前后对比 Fig.1 The comparison of pre-and post-SGIV-infected GS cells |
|
*P < 0.05,差异显著; **P < 0.01,差异极显著 A P value < 0.05 was considered statistically significant (*P < 0.05, **P < 0.01) 图 2 Q2-AFMP特异性检测SGIV感染结果 Fig.2 The results of Q2-AFMP specifically detected SGIV-infected cells |
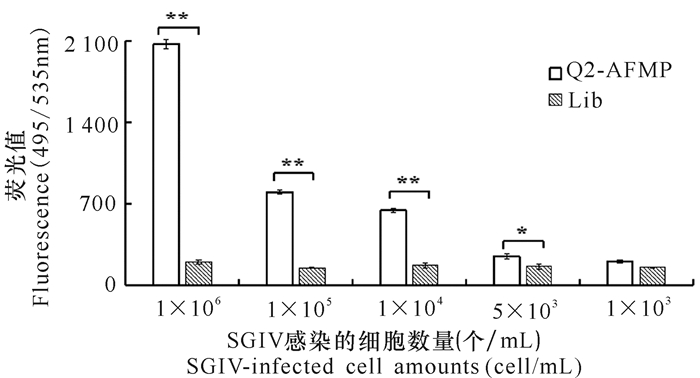
对照组中FITC-ssDNA Library与不同数目的SGIV感染细胞结合后的荧光值均很低且没有明显差异,而使用Q2-AFMP检测SGIV感染时,SGIV感染细胞的数量越多,实验组中待测样品在495/535 nm处的荧光值就越高,即Q2-AFMP能够以数量梯度依赖的方式检测SGIV的感染。当SGIV感染细胞的数目少至5×103个/mL时,Q2-AFMP仍可灵敏地检测到SGIV的感染(图 3)。
|
*P < 0.05,差异显著; **P < 0.01,差异极显著 A P value < 0.05 was considered statistically significant (*P < 0.05, **P < 0.01) 图 3 Q2-AFMP检测SGIV感染细胞的数量灵敏性 Fig.3 The sensitivity of Q2-AFMP for SGIV-infected cell amounts |
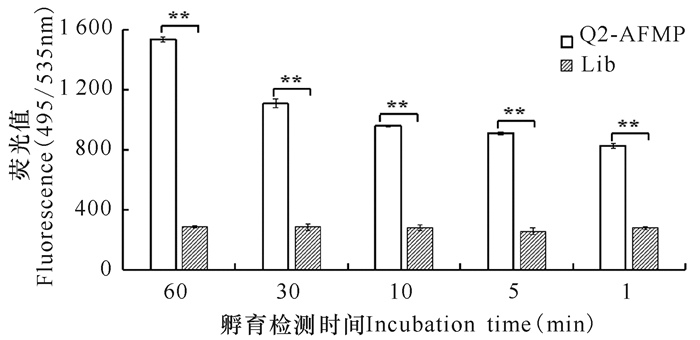
与对照组中不同孵育结合时间条件下的荧光检测值均较低且没有明显差异的结果相比,实验组中使用Q2-AFMP检测SGIV的感染时,孵育结合时间越长,实验组中待测样品在495/535 nm处的荧光值就越高,即Q2-AFMP以孵育结合时长依赖的方式检测SGIV的感染。当孵育结合时长短至1 min时,Q2-AFMP仍可灵敏地检测到SGIV的感染(图 4)。因此,Q2-AFMP可以用于石斑鱼养殖中SGIV感染的快速检测诊断。
|
*P < 0.05,差异显著; **P < 0.01,差异极显著 A P value < 0.05 was considered statistically significant (*P < 0.05, **P < 0.01) 图 4 Q2-AFMP检测SGIV感染细胞的时间灵敏性 Fig.4 The time sensitivity of Q2-AFMP for SGIV-infected cells |
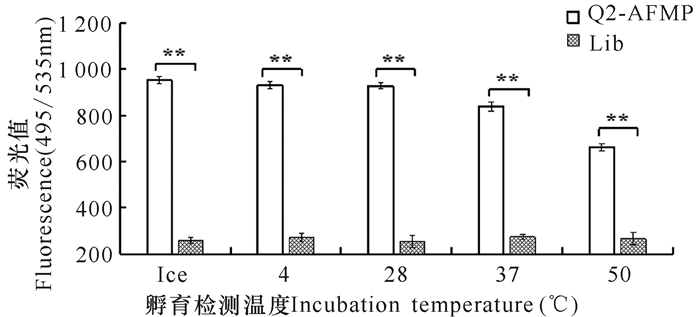
在不同温度的结合条件下,对照组中不同孵育温度条件下的荧光值均较低且没有明显差异。利用Q2-AFMP检测SGIV的感染时,当检测温度为冰上、4℃和28℃时,实验组中待测样品在495/535 nm处的荧光值最高,检测温度升高至37℃时,酶标仪检测到的荧光值仅略有下降。随着温度的升高,实验组中待测样品的荧光值逐渐降低,当温度升高至50℃时,Q2-AFMP仍可准确地检测到SGIV的感染,由此证明新型Q2-AFMP具有极高的稳定性(图 5)。
|
*P < 0.05,差异显著; **P < 0.01,差异极显著 A P value < 0.05 was considered statistically significant (*P < 0.05, **P < 0.01) 图 5 不同温度下Q2-AFMP检测SGIV感染的稳定性分析 Fig.5 Stability analysis of SGIV infection by Q2-AFMP detection at different temperatures |
近年来频繁暴发的石斑鱼虹彩病毒病重创了我国的石斑鱼养殖业[5, 16]。因此应着力开发海水养殖中针对SGIV感染的大批量、快速检测、精确诊断的技术,以实现在病害感染的早期及时发现病原,进而采取相应措施来阻止病毒扩散并降低病毒感染鱼体的机率。作为一种新型的分子探针,核酸适配体具有易筛选获得、易于合成和修饰、高特异性和高亲和性识别并结合靶物质的优良性质[17-18]。作为传统抗体的替代物,核酸适配体目前在基础研究、分析检测、临床诊断和新药研发领域等方面均具有广阔的应用前景[19-20]。
在先前的研究中,我们以石斑鱼虹彩病毒SGIV为研究对象,以SGIV感染的石斑鱼细胞为靶标进行SELEX筛选,获得的核酸适配体不仅可以高特异性的识别虹彩病毒SGIV感染的石斑鱼细胞,还可以识别SGIV感染的石斑鱼组织,这表明筛选得到的核酸适配体具有发展成为高特异性检测分子探针的潜力[4]。本研究中我们基于核酸适配体(Q2)就石斑鱼虹彩病毒病的快速检测诊断技术进行研究,开发出一种新型的核酸适配体-荧光分子检测探针(Aptamer Q2-based fluorescent molecular probe,Q2-AFMP),并对Q2-AFMP检测石斑鱼虹彩病毒SGIV感染的特异性、灵敏性和稳定性进行了分析。结果发现,Q2-AFMP用于检测石斑鱼虹彩病毒SGIV感染,不仅特异性很强,而且灵敏度高,因此Q2-AFMP完全能够满足快速诊断石斑鱼虹彩病毒SGIV感染的目的。对Q2-AFMP的稳定性进行分析则发现,Q2-AFMP在冰上、4℃和28℃的检测环境中,其检测效果最好,当检测环境温度达到50℃时,Q2-AFMP仍可准确地检测到石斑鱼虹彩病毒SGIV的感染,即新型Q2-AFMP用于检测SGIV的感染具有极高的稳定性。综上,Q2-AFMP能够高特异性检测SGIV的感染,并且具有耗时短、灵敏性高、稳定性强等优点,为丰富和提高各领域的检测技术提供了新方法和新思路,在石斑鱼虹彩病毒SGIV快速检测领域具有极为广阔的应用前景。
4 结论本研究基于先前利用SELEX技术筛选获得的能够高特异性识别SGIV感染的核酸适配体,开发出一种新型的核酸适配体-荧光分子检测探针(Q2-AFMP),并对其特异性、灵敏性和稳定性进行分析。结果显示,Q2-AFMP能够用于海水养殖中石斑鱼虹彩病毒病的特异性检测,而且Q2-AFMP检测SGIV感染具有耗时短、灵敏性高、稳定性强等优点。未来研究中,将进一步优化核酸适配体Q2的结构以降低Q2-AFMP的生产成本,并开发出相应的快速检测试剂盒在海水养殖企业中推广使用,以实现对广西海水养殖中石斑鱼虹彩病毒病的快速诊断、实时监控和有效预防。
| [1] |
刘锡强, 马学坤, 刘康, 等. 华南地区金鲳鱼养殖报告[J]. 当代水产, 2014(2): 26-29. LIU X Q, MA X K, LIU K, et al. Reports on the cultured Trachinotus ovatus in South China[J]. Current Fisheries, 2014(2): 26-29. |
| [2] |
QIN Q W, CHANG S F, NGOH G H, et al. Characterization of a novel ranavirus isolated from grouper, Epinephelus tauvina[J]. Dis Aquat Org, 2003, 53(1): 1-9. |
| [3] |
LI P F, YAN Y, WEI S N, et al. Isolation and characterization of a new class of DNA aptamers specific binding to Singapore grouper iridovirus (SGIV) with antiviral activities[J]. Virus Research, 2014, 188: 146-154. DOI:10.1016/j.virusres.2014.04.010 |
| [4] |
LI P F, WEI S N, ZHOU L L, et al. Selection and characterization of novel DNA aptamers specifically recognized by Singapore grouper iridovirus-infected fish cells[J]. J Gen Virol, 2015, 96: 3348-3359. DOI:10.1099/jgv.0.000270 |
| [5] |
LI P F, ZHOU L L, WEI J G, et al. Development and characterization of aptamer-based enzyme-linked apta-sorbent assay for the detection of Singapore grouper iridovirus infection[J]. J Appl Microbiol, 2016, 121(3): 634-643. DOI:10.1111/jam.2016.121.issue-3 |
| [6] |
QIN Q W, GIN K Y H, LEE L Y, et al. Development of a flow cytometry based method for rapid and sensitive detection of a novel marine fish iridovirus in cell culture[J]. J Virol Methods, 2005, 125: 49-54. DOI:10.1016/j.jviromet.2004.12.005 |
| [7] |
SHI C J, QIN Q W, GIN K Y H, et al. Production and characterization of monoclonal antibodies to a grouper iridovirus[J]. J Virol Methods, 2003, 107(2): 147-154. DOI:10.1016/S0166-0934(02)00212-4 |
| [8] |
HUANG C H, ZHANG X B, GIN K Y H, et al. In situ hybridization of a marine fish virus, Singapore grouper iridovirus with a nucleic acid probe of major capsid protein[J]. J Virol Methods, 2004, 117: 123-128. DOI:10.1016/j.jviromet.2004.01.002 |
| [9] |
MAO X L, ZHOU S, XU D, et al. Rapid and sensitive detection of Singapore grouper iridovirus by loop-mediated isothermal amplification[J]. J Appl Microbiol, 2008, 105(2): 389-397. DOI:10.1111/jam.2008.105.issue-2 |
| [10] |
ELLINGTON A D, SZOSTAK J W. In vitro selection of RNA molecules that bind specific ligands[J]. Nature, 1990, 346: 818-822. DOI:10.1038/346818a0 |
| [11] |
CHO Y, LEE Y B, LEE J H, et al. Modified AS1411 aptamer suppresses hepatocellular carcinoma by up-regulating galectin-14[J]. PLos One, 2016, 11(8): E0160822. DOI:10.1371/journal.pone.0160822 |
| [12] |
KUMAR P K R. Monitoring intact viruses using apta-mers[J]. Biosensors (Basel), 2016, 6(3): E40. |
| [13] |
ZHOU J H, ROSSI J J. Therapeutic potential of apta-mer-siRNA conjugates for treatment of HIV-1[J]. BioDrugs, 2012, 26(6): 393-400. DOI:10.1007/BF03261896 |
| [14] |
LI P F, WEI S N, ZHOU L L, et al. Selection and characterization of the novel DNA-aptamers specifically recognized Singapore grouper iridovirus (SGIV) infected fish cells[J]. J Gen Virol, 2015, 96(11): 3348-3359. DOI:10.1099/jgv.0.000270 |
| [15] |
BUNKA D H J, STOCKLEY P G. Aptamers come of age-at last[J]. Nat Rev Microbiol, 2006, 4(8): 588-596. DOI:10.1038/nrmicro1458 |
| [16] |
QIN Q W, LAM T J, SIN Y M, et al. Electron microscopic observations of a marine fish iridovirus isolated from brown-spotted grouper, Epinephelus tauvina[J]. J Virol Methods, 2001, 98: 17-24. DOI:10.1016/S0166-0934(01)00350-0 |
| [17] |
DUAN N, WU S J, WANG Z P. An aptamer-based flu-orescence assay for ochratoxin A[J]. Chinese Journal of Analytical Chemistry, 2011, 39(3): 300-304. DOI:10.1016/S1872-2040(10)60423-9 |
| [18] |
LIANG H R, LIU Q, ZHENG X X, et al. Aptamers targeting rabies virus-infected cells inhibit viral replication both in vitro and in vivo[J]. Virus Research, 2013, 173(2): 398-403. DOI:10.1016/j.virusres.2012.12.017 |
| [19] |
BUMCROT D, MANOHARAN M, KOTELIANSKY V, et al. RNAi therapeutics:A potential new class of pharmaceutical drugs[J]. Nat Chem Bio, 2006, 2(12): 711-719. DOI:10.1038/nchembio839 |
| [20] |
BUNKA D H J, PLATONOVA O, STOCKLEY P G. Development of aptamer therapeutics[J]. Curr Opin Pharmacol, 2010, 10(5): 557-562. DOI:10.1016/j.coph.2010.06.009 |
 2018, Vol. 25
2018, Vol. 25 


