2. 海洋环境与生态教育部重点实验室, 山东青岛 266100;
3. 中国海洋大学环境科学与工程学院, 山东青岛 266100;
4. 广西大学动物科学技术学院, 广西南宁 530004
2. Key Laboratory of Marine Environment and Ecology, Ministry of Education, Qingdao, Shandong, 266100, China;
3. College of Environmental Science and Engineering, Ocean University of China, Qingdao, Shandong, 266100, China;
4. College of Animal Science and Technology, Guangxi University, Nanning, Guangxi, 530004, China
【研究意义】短链氯化石蜡(Short-chain Chlorinated Paraffins,SCCPs)是碳链长度为10~13个碳原子,氯化程度30%~70%的氯化石蜡(Chlorinated Paraffins,CPs)。SCCPs成分复杂,具有持久性、生物累积性、长距离迁移能力等持久性有机污染物(Persistent Organic Pollutants, POPs)特性。美国环境保护署、加拿大环境保护署、欧洲水框架协议等均将其列为优控危险物品[1-2],《关于持久性有机污染物(POPs)斯德哥尔摩公约》也将其列入POPs备选清单[3]。相对于中链氯化石蜡和长链氯化石蜡,SCCPs更易释放入环境,在水、底泥、大气、生物体甚至边缘地区均有检出[4]。【前人研究进展】目前毒理学研究表明SCCPs对哺乳动物有较低的毒性。SCCPs能增加啮齿类动物肝脏、甲状腺、肾脏癌症发病率[5-6],不同剂量的SCCPs会导致大鼠出现如脊椎突出、呼吸异常、活动减少,死亡等现象[7]。SCCPs具有较明显的水生生物毒性,特别是对水生无脊椎生物。Firsk等[8]发现SCCPs对日本青鳉Oryzias latipes胚胎具有毒性作用。刘丽华等[9]发现不同剂量的SCCPs可造成斑马鱼胚胎发育畸形、死亡率上升,抑制幼鱼生长。另有研究表明20~24 μg/L即可明显观察到SCCPs对大型蚤Daphnia magna和糠虾Mysidopsis bahia的慢性毒性效应[10-11]。Brown等[12]则发现贻贝Mytilus edilus对于CPs的最低影响浓度为9.3 mg/L。【本研究切入点】中国是世界氯化石蜡生产和使用第一大国,但关于SCCPs环境污染现状的数据和生态毒性研究仍然欠缺。目前为止,SCCPs的毒性作用机制尚不明确,系统的毒性评价依然缺乏,特别是对海洋双壳贝类的毒性作用鲜有报道。红树林是中国华南沿海海岸带和河口潮间带的重要生态系统,是陆源污染物和海洋污染物的“汇”。红树蚬Polymesoda erosa与歪红树蚬Polymesoda expansa作为红树林区的两种重要双壳贝类,混合分布于中、高潮带。它们具有体型适中、分布广泛、数量多、易采集等优点[13]。【拟解决的关键问题】在准确区分两种蚬的基础上,通过研究两种蚬血液的3种生物标志物对SCCPs的响应,期望了解两种蚬对SCCPs胁迫的作用机制及应答差别。
1 材料与方法 1.1 试验贝的采集与驯养试验用红树蚬及歪红树蚬采集于广西北海市廉州湾草头村红树林区(21°33′28"N,109°9′22"E),经物种鉴定及形态判别后挑选出大小相近的个体用于试验,经测定,供试红树蚬鲜重(31.21±1.34) g/个,壳长(47.3±3.2) mm,壳宽(24.26±2.8) mm,壳高(42.11±2.7) mm;歪红树蚬鲜重(30.11±3.06) g/个,壳长(49.3±5.6) mm,壳宽(25.06±2.3) mm,壳高(40.8±1.9) mm。在塑料筐中驯养5 d,驯养密度为每升水2个贝,微充气,每天换水后投喂扁藻。试验用水为自来水与沙滤海水混合后经充分曝气的半自然海水,盐度为(15±1)‰,水质符合渔业水质标准(GB 11607—1989)。
1.2 胁迫处理SCCPs(CAS85535-84-8)购自北京汤普森生物科技有限公司,氯含量(42±2)%。依据预试验结果,设置SCCPs浓度为0.5 mg/L、1.0 mg/L、5.0 mg/L、10.0 mg/L、20.0 mg/L共5个胁迫组,1个对照组和1个二甲基亚砜(DMSO)溶剂对照组。每组红树蚬与歪红树蚬各设2个平行样,每个平行样试验开始时有16个贝。在胁迫试验的第0天,1天,3天,5天,7天和15天,以及解除胁迫的第3天(R3 d)和第15天(R15 d)分别取样,每组每次随机取4个红树蚬、4个歪红树蚬,单独检测每个贝的各项生物标志物指标。胁迫期间每天取样后完全换水1次后投喂扁藻。按照每个贝0.5 L水计,维持原SCCPs、DMSO浓度,24 h不间断微充气。恢复期间每天换水后只加扁藻。试验期间,温度26~28℃,盐度(15±1)‰。
1.3 生物标志物检测用1 mL一次性注射器分别抽取两种蚬的闭壳肌血液,注入对应编号离心管中,用于相关标志物的检测。MDA采用改进的硫代巴比妥酸比色法测定[14],溶酶体膜稳定性采用中性红保持时间法(Neutral Red Retention Time, NRRT)测定[15]。血液的总抗氧化活力(Total Antioxidant Capacity,T-AOC)测定参照Benziei和Strain[16]的方法。血液中总蛋白含量采用BCA法测定[17]。
1.4 数据分析试验数据采用单因素方差分析进行显著性检验,P<0.05认为存在显著性差异,P<0.01认为存在极显著差异。采用标记字母法显示显著性检验结果。
2 结果与分析 2.1 红树蚬对SCCPs的响应红树蚬3种生物标志物空白对照组和DMSO组在胁迫及恢复阶段均无显著差异(P>0.05)。
红树蚬NRRT变化随剂量-时间变化表现出不同的趋势(图 1)。SCCPs低浓度胁迫组(0.5 mg/L、1.0 mg/L)在胁迫早期(1 d)对红树蚬NRRT呈现明显的正诱导作用(P<0.05),表现出“毒物兴奋效应”[18];中等浓度(5.0 mg/L)以上胁迫组,红树蚬NRRT随时间延长呈逐渐下降趋势(P<0.05),其中高浓度(10.0 mg/L、20.0 mg/L)胁迫组在胁迫初期(1 d)NRRT显著低于对照组(P<0.01)。去除胁迫后,各胁迫组NRRT均有不同程度提高,但未能恢复到对照组水平(P<0.05)。

|
不同小写字母表示差异显著(P<0.05) lowercase letters indicate significant difference (P < 0.05) 图 1 不同SCCPs浓度下红树蚬血液溶酶体中性红保持时间(n=4) Fig.1 Effects of SCCPs on NRRT in the blood of Polymesoda erosa (n=4) |
红树蚬总抗氧化活力(T-AOC)变化趋势如图 2所示。在胁迫初期(1 d)各胁迫组T-AOC值相对于对照组显著提高(P<0.01)。0.5 mg/L胁迫组在胁迫5 d时T-AOC仍保持了较高活力,从胁迫第7天,T-AOC值显著下降。其他胁迫组从胁迫第3天起T-AOC值逐渐下降。去胁迫R15 d时,各胁迫组T-AOC值均能够恢复到对照组水平(P>0.05)。
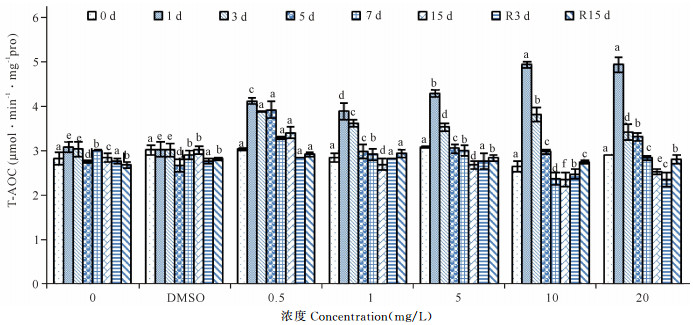
|
不同小写字母表示差异显著(P<0.05) The lowercase letters indicate significant difference (P < 0.05) 图 2 不同SCCPs浓度下红树蚬血液总抗氧化化活力(n=4) Fig.2 Effects of SCCPs on T-AOC in the blood of Polymesoda erosa (n=4) |
红树蚬各胁迫组MDA含量如图 3所示,0.5 mg/L、1.0 mg/L组呈现上升-下降-上升的趋势;去胁迫后,MDA含量逐渐下降,但未能恢复到对照组水平(P<0.05)。5.0 mg/L及以上胁迫组随暴露时间延长MDA含量逐渐升高;去胁迫后,R3 d时MDA含量仍略有提高,R15 d时MDA含量虽呈下降趋势,但仍显著高于对照组水平(P<0.05)。
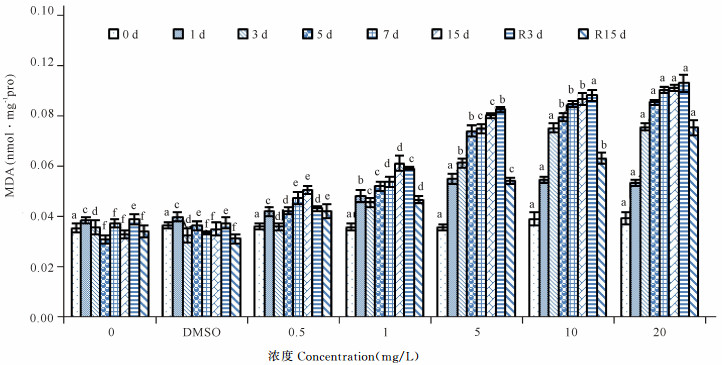
|
不同小写字母表示差异显著(P<0.05) The lowercase letters indicate significant difference (P < 0.05) 图 3 不同SCCPs浓度下红树蚬血液中MDA含量(n=4) Fig.3 Effects of SCCPs on MDA in the blood of Polymesoda erosa (n=4) |
歪红树蚬3种生物标志物空白对照组和DMSO组在胁迫及恢复阶段均无显著差异(P>0.05)。
歪红树蚬各胁迫组NRRT变化趋势如图 4所示。SCCPs低浓度胁迫组(0.5 mg/L)在胁迫早期(1 d)对歪红树蚬NRRT呈现明显的正诱导作用(P<0.01),表现出“毒物兴奋效应”[18],之后随胁迫时间延长,NRRT逐渐降低。1.0 mg/L及以上胁迫组,NRRT从胁迫初期即逐渐降低,其中中等浓度(5.0 mg/L)、高浓度(10.0 mg/L、20.0 mg/L)组在胁迫初期(1 d)NRRT显著低于对照组水平(P<0.01)。去除胁迫后,各胁迫组NRRT均有不同程度提高,其中低浓度胁迫组(0.5 mg/L、1.0 mg/L)能恢复到对照组水平(P>0.05)。
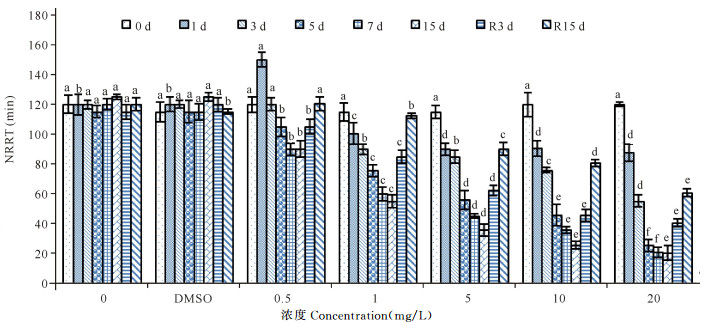
|
不同小写字母表示差异显著(P<0.05) The lowercase letters indicate significant difference (P < 0.05) 图 4 不同SCCPs浓度下歪红树蚬血液溶酶体中性红保持时间(n=4) Fig.4 Effects of SCCPs on NRRT in the blood of Polymesoda expansa (n=4) |
歪红树蚬各胁迫组总抗氧化活力(T-AOC)变化见图 5。各胁迫组在胁迫初期(1 d)T-AOC相对于对照组显著提高(P<0.01),其中低浓度(0.5 mg/L、1.0 mg/L)组在胁迫第5天时仍保持了较高的总抗氧化活力,从胁迫第7天,上述T-AOC值逐渐下降;中、高浓度组(>5.0 mg/L)从第3天起T-AOC值逐渐下降,各胁迫组在第15天时T-AOC值低于对照组水平(P<0.05)。去胁迫后R15 d时,除20.0 mg/L组外,其他胁迫组的T-AOC值能够恢复到对照组水平。

|
不同小写字母表示差异显著(P<0.05) The lowercase letters indicate significant difference (P < 0.05) 图 5 不同SCCPs浓度下歪红树蚬血液总抗氧化化活力(n=4) Fig.5 Effects of SCCPs on T-AOC in the blood of Polymesoda expansa (n=4) |
歪红树蚬各胁迫组MDA含量如图 6所示,低浓度胁迫组(0.5 mg/L、1.0 mg/L)呈现缓慢上升的趋势,其中0.5 mg/L组在胁迫第3天时MDA含量仍保持了较低的水平;去胁迫后,MDA含量逐渐下降,0.5 mg/L组能恢复到对照组水平(P>0.05)。5.0 mg/L及以上胁迫组从胁迫初期(1 d)MDA含量即显著提高(P<0.01),并随暴露时间延长MDA含量逐渐升高;去胁迫后,R3 d时MDA含量仍略有提高,R15 d时MDA含量虽呈下降趋势,但仍显著高于对照组水平(P<0.05)。
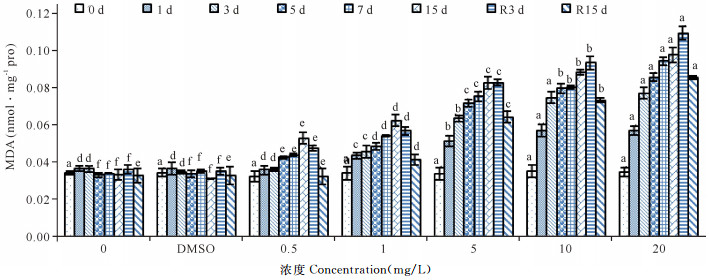
|
不同小写字母表示差异显著(P<0.05) The lowercase letters indicate significant difference (P < 0.05) 图 6 不同SCCPs浓度下歪红树蚬血液MDA含量(n=4) Fig.6 Effects of SCCPs on MDA in the blood of Polymesoda expansa (n=4) |
溶酶体是细胞内的消化和防御体系[19]。研究表明溶酶体系统对化学污染物高度敏感,可利用溶酶体对环境污染物的应答来预测水生生物细胞功能状态[20]。本研究中,SCCPs低浓度胁迫组(0.5 mg/L、1.0 mg/L)在胁迫早期(1 d)对红树蚬NRRT呈现明显的正诱导作用;0.5 mg/L胁迫组对歪红树蚬呈正诱导作用,这种现象产生的原因可能是有些有机污染物在胁迫早期对受试生物具有短暂的诱导作用。另有研究表明双壳类消化腺细胞对污染物的应答首先是水解酶被激活并释放到胞质,接着才出现溶酶体膜去稳定导致增加溶酶体膜的融合和扩张[21-22],蚬血细胞对污染物的应答可能也存在相似情况。中等浓度以上胁迫组,红树蚬与歪红树蚬NRRT均随时间延长呈逐渐下降趋势。
SCCPs在生物体内代谢与转化过程中会产生大量的活性氧(Reactive Oxygen Species,ROS),这些活性氧会对生物体产生损害。总抗氧化活力是机体包括抗氧化酶系统和非酶促系统功能整体状况的综合性衡量指标。试验中红树蚬、歪红树蚬在低浓度SCCPs胁迫的一定时期内能对机体形成有效保护,中、高浓度时随胁迫时间延长,T-AOC值显著下降,表明机体受到了SCCPs损害。虽然歪红树蚬最大T-AOC值低于红树蚬,但歪红树蚬T-AOC值随剂量-时间变化降低速度较慢,对于逆境的抵抗力更强,尤其在低浓度时表现较为明显。MDA是脂质过氧化的产物,对细胞膜有很强的破坏作用,其含量可反映机体内自由基产生量及对机体的影响程度。Bebianno等[23]提出高含量MDA是抗氧化防御机能丧失的结果。本试验MDA含量变化与T-AOC值变化呈负相关,在低浓度条件下的胁迫早期(3 d)两种蚬MDA含量上升比较缓慢,表明生物体受到抗氧化系统的有效保护。低浓度胁迫中后期及中、高浓度胁迫组MDA含量逐渐上升,显然是由于抗氧化系统遭到了破坏,导致机体内活性氧更迅速累积,从而加剧了膜脂过氧化作用。
4 结论红树蚬与歪红树蚬对SCCPs胁迫应答随剂量-时间变化总体趋势相似。在低浓度SCCPs水平胁迫早期,两种蚬均表现出“毒物兴奋效应”,其中红树蚬表现更为明显;两种蚬对中、高浓度SCCPs胁迫响应结果相似。歪红树蚬对于逆境的抵抗力更强。
| [1] |
王亚韡, 蔡亚岐, 江桂斌. 斯德哥尔摩公约新增持久性有机污染物的一些研究进展[J]. 中国科学(化学), 2010, 40(2): 99-123. WANG Y W, CAI Y Q, JIANG G B. Research processes of persistent organic pollutants (POPs) newly listed and candidate POPs in Stockholm Convention[J]. Scientia Sinica Chimica, 2010, 40(2): 99-123. |
| [2] |
European Community.COMMISSION REGULATION (EU) 2015/2030 of 13 November 2015 amending Regulation (EC) No 850/2004 of the European Parliament and of the Council onpersistent organic pollutants as regards Annex I[R]. European Community, 2015.
|
| [3] |
吴苹, 赫巍, 张海军, 等. 短链氯化石蜡限用对我国氯化石蜡产业的影响[J]. 现代化工, 2013, 33(1): 17-21. WU P, HE W, ZHANG H J, et al. Influence of restricted utilization of short-chain chlorinated paraffins on the chlorinated paraffin industry in China[J]. Modern Chemical Industry, 2013, 33(1): 17-21. |
| [4] |
陈茹, 王亚韡, 王璞, 等. 短链氯化石蜡在台州电子拆解地区的分布特征[J]. 环境化学, 2014, 33(6): 873-879. CHEN R, WANG Y W, WANG P, et al. Spatial distribution of short chain chlorinated paraffins in soils from Taizhou, an e-waste dismantling area[J]. Environmental Chemistry, 2014, 33(6): 873-879. DOI:10.7524/j.issn.0254-6108.2014.06.001 |
| [5] |
BUCHER J R, ALISON R H, MONTGOMERY C A, et al. Comparative toxicity and carcinogenicity of two chlorinated paraffins in F344/N rats and B6C3F1 mice[J]. Fundamental and Applied Toxicology, 1987, 9(3): 454-468. DOI:10.1016/0272-0590(87)90028-5 |
| [6] |
SERRONE D M, BIRTLEY R D N, WEIGAND W, et al. Toxicologyof chlorinated paraffins[J]. Food and Chemical Toxicology, 1987, 25(7): 553-562. DOI:10.1016/0278-6915(87)90209-2 |
| [7] |
UNEP, POPs Review Committee.Consideration of draft risk profiles:Short-chained chlorinated paraffins (UNEP/POPS /POPRC.4 /10)[R]. Geneva:UNEP, 2008.
|
| [8] |
FIRSK A T, TOMY G T, MUIR D C G. Toxicity of, and polychlorinated alkanes to Japanese medaka (Oryzias latipes) embryos[J]. Environmental Toxicology and Chemistry, 1999, 18(12): 2894-2902. |
| [9] |
刘丽华, 马万里, 刘丽艳, 等. 短链氯化石蜡C10(50.2% Cl)对斑马鱼胚胎的发育毒性[J]. 哈尔滨工业大学学报, 2016, 48(8): 127-130, 140. LIU L H, MA W L, LIU L Y, et al. Study on developmental toxicity of short-chain chlorinated paraffins C10(50.2% Cl) in zebrafish embryos[J]. Journal of Harbin Institute of Technology, 2016, 48(8): 127-130, 140. DOI:10.11918/j.issn.0367-6234.2016.08.021 |
| [10] |
李慧娟. 短链氯化石蜡在东海近海环境中的分布及迁移转化研究[D]. 青岛: 中国海洋大学, 2013. LI H J.The distribution and migration of short chainchlorinated paraffins in the offshore regions of East China Sea[D]. Qingdao:Ocean University of China, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10423-1013367258.htm |
| [11] |
THOMPSON R, MADELEY J.The acute and chronic toxicity of a chlorinated paraffin to themysid shrimp (Mysidopsisbahia)[R]. Brixham Report BL/B/2373.Devon, UK:Imperial Chemical Industries PLC, 1983.
|
| [12] |
BROWN D, THOMPSON R S. Phthalates and the aqu-atic environment:PartⅡ The bioconcentration and depuration of di-2-ethyl-hexyl phthalate (DEHP) and di-isodecyl phthalate (DIDP) in mussels (mytilus-edulis)[J]. Chemosphere, 1982, 11(4): 427-435. DOI:10.1016/0045-6535(82)90046-7 |
| [13] |
周浩郎, 张俊杰, 邢永泽, 等. 广西红树蚬的分布特征及影响因素分析[J]. 广西科学, 2014, 21(2): 147-152. ZHOU H L, ZHANG J J, XING Y Z, et al. Characteristics of distribution and the influential factors of mangrove clam, Polymesoda erosa (Solander 1786), in Guangxi[J]. Guangxi Sciences, 2014, 21(2): 147-152. |
| [14] |
郝再彬, 苍晶, 徐仲. 植物生理实验[M]. 哈尔滨: 哈尔滨工业大学出版社, 2004: 106-108, 113-115. HAO Z B, CANG J, XU Z. Plant physiology experiment[M]. Harbin: Harbin Institute of Technology Press, 2004: 106-108, 113-115. |
| [15] |
FERNLEY P W, MOORE M N, LOWE D M, et al. Im-pact of the sea Empress oil spill on lysosomal stability in mussel blood cells[J]. Marine Environmental Research, 2000, 50(1/2/3/4/5): 451-455. |
| [16] |
BENZIEI F F, STRAIN J J. The ferric reducing ability of plasma as a measure of "antioxidant power":The FRAP assay[J]. Analytical Biochemistry, 1996, 239(1): 70-76. DOI:10.1006/abio.1996.0292 |
| [17] |
SMITH P K, KROHN R I, HERMANSON G T, et al. Measurement of protein using bicinchoninicacid[J]. Analytical Biochemistry, 1985, 150(1): 76-85. DOI:10.1016/0003-2697(85)90442-7 |
| [18] |
STEBBING A R D. Hormesis-the stimulation of grow-th by low levels of inhibitiors[J]. Science of Total Environment, 1982, 22(1): 213-234. |
| [19] |
HAVELAAR A C, DE GAST I L, SNIJDERS S, et al. Characterization of a heavy metal ion transporter in the lysosomal membrane[J]. FEBS Letters, 1998, 436(2): 223-227. DOI:10.1016/S0014-5793(98)01133-8 |
| [20] |
MOORE M N, ALLEN J L, MCVEIGH A, et al. Lysosomal and autophagic reactions as predictive indicators of environmental impact in aquatic animals[J]. Autophagy, 2006, 2(3): 217-220. DOI:10.4161/auto.2663 |
| [21] |
LOWE D M, MOORE M N, CLARKE K R. Effects of oil on digestive cells in mussels:Quantitative alterations in cellular and lysosomal structure[J]. Aquatic Toxicology, 1981, 1(3/4): 213-226. |
| [22] |
MOORE M N, CLARKE K R. Use of microstereology and quantitative cytochemistry to determine the effects of crude oil-derived aromatic hydrocarbons on lysosomal structure and function in a marine bivalve mollusk, Mytilus edulis[J]. Histochemical Journal, 1982, 14(5): 713-718. DOI:10.1007/BF01033620 |
| [23] |
BEBIANNO M J, SERAFIM A, CAMUS L, et al. Antioxidant systems and lipid peroxidation in Bathymodiolu sazoricus from Mid-Atlantic Ridge hydrothermal vent fields[J]. Aquatic Toxicology, 2005, 75(4): 354-373. DOI:10.1016/j.aquatox.2005.08.013 |
 2017, Vol. 24
2017, Vol. 24 


