2. 广西科学院广西红树林研究中心,广西红树林保护与利用重点实验室,广西北海 536000;
3. 广西师范学院地理科学与规划学院,广西南宁 530001
2. Guangxi Key Lab of Mangrove Conservation and Utilization, Guangxi Mangrove Research Center, Guangxi Academy of Sciences, Beihai, Guangxi, 536000, China;
3. School of Geography and Planning, Guangxi Teachers Education University, Nanning, Guangxi, 530001, China
【研究意义】海草床生态系统与红树林、珊瑚礁生态系统并称为三大典型海洋生态系统,在固定CO2、释放氧气,稳定底质,净化水质以及维持近岸高生物多样性方面均具有重要作用[1-2]。海草床是近岸海域中生产力极高的生态系统,具有丰富的生物多样性和重要的生态服务功能[2-3]。大型底栖动物为海草床生态系统的重要组成部分[4-5],为人类提供了丰富的蛋白质来源。尤其以裸体方格星虫(Sipunculus nudus)最受人们的喜爱,不仅味道鲜美,其所含的纤溶酶还具有直接溶解纤维蛋白和激活纤溶酶原的双重作用,对预防和治疗血栓性疾病具有一定的药用价值[6]。【前人研究进展】对海床的人为物理干扰分为2种:一种是采用铁铲、锄头、耙或类似的工具进行人工挖掘,其中人工挖掘方式又分非连片集中式和连片集中式;另一种是利用高压水枪捕捞。通过走访广西北海市沿海居民了解到,传统的人工挖掘方式人均一天最多可采集裸体方格星虫10 kg,但利用高压水枪冲击滩涂捕捞,人均一天可采集60~100 kg。近年来,裸体方格星虫的市场价格持续走高,但挖掘的人工成本也越来越高。为了提高采集效率节省人工成本,沿海群众利用高压水枪冲击滩涂使其浆化,迫使裸体方格星虫翻滚至表面便于捕捞。然而,利用高压水枪冲击滩涂可能会导致滩涂底质理化性质发生改变,并对其生物多样性产生较大影响。对此,政府部门出台了相关的管理条例[7-8],严禁利用高压水枪采集海洋经济动物,但类似行为仍屡禁不止。【本研究切入点】当前,相关研究机构、管理部门及社会公众对人为物理干扰(如使用高压水枪)采集海洋经济动物的生态影响的评估多建立在“想当然”的推断上,缺乏相应的生态影响的定量研究。【拟解决的关键问题】本研究量化分析高压水枪冲击和连片式人工挖掘后,广西北海竹林海草床的海草群落和大型底栖动物群落结构的影响情况,旨在为沿海滩涂和海草床的生物多样性保护以及政府部门管理决策的制定提供科学依据。
1 材料与方法 1.1 研究地点概况研究地点位于广西壮族自治区北海市银海区竹林盐场外海潮间带的竹林海草床(21°26′06″N, 109°16′48″E)。该海草床于2008年加入“全球海草监测网(SeagrassNet)”[9],优势海草为喜盐草(Halophila ovalis)。近年来,越来越多的群众到海草床及相邻滩涂进行经济动物(主要是裸体方格星虫和竹蛏Solen spp.)的养殖,而收获方式既有连片式人工挖掘的方式,也有利用高压水枪冲击采集的方式。因此,该地是研究人为物理干扰对海草床群落生态影响的理想场所。
研究地区属南亚热带季风型海洋性气候,年均日照时数为1 790~1 800 h,年均气温23.4℃,气温年变化幅度约为13.8℃,10℃年均积温7 708~8 261℃;年均降水量1 500~1 700 mm,年均蒸发量1 000~1 400 mm,平均相对湿度为80%;海水年均温度为23.5℃,盐度为20‰~23‰,pH值7.60~7.80。该区受季风影响,海陆风特征明显;海域潮汐为非正规全日潮,一年中约60%时间为1天1次潮,其余时间为1天2次潮,年平均潮差在2.31~2.59 m[10]。
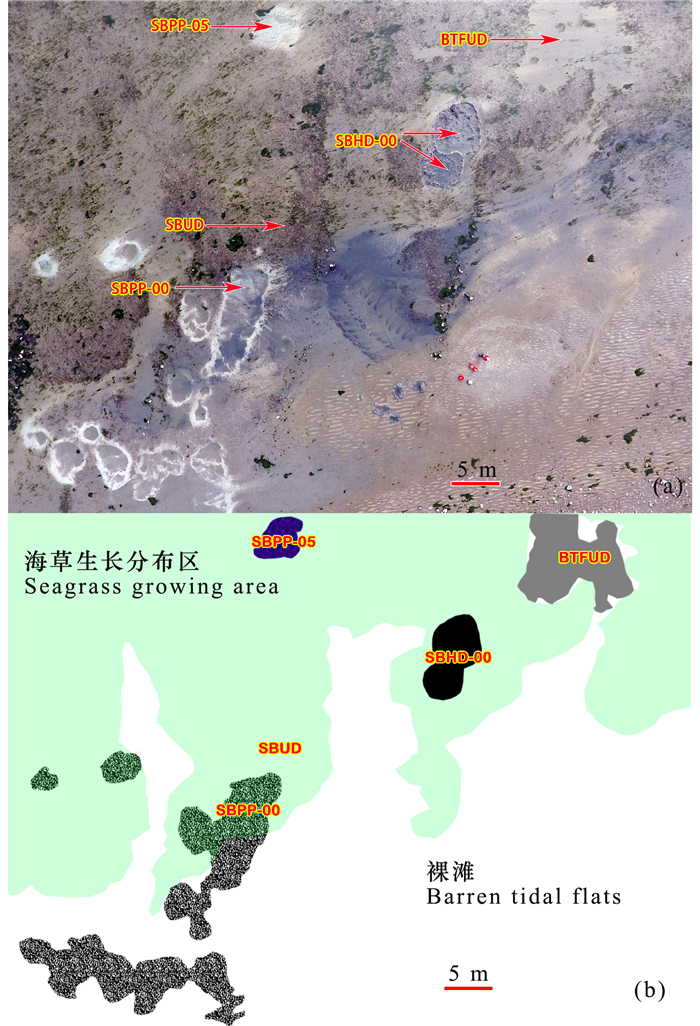
1.2 样地布设及采样方法2017年1月根据地面调查配合无人机航拍的结果,将调查区分为5种生境类型(图 1):(1)未受人为直接干扰的海草区(Seagrass Bed Undisturbed,SBUD);(2)未受人为干扰的裸滩(Barren Tidal Flats Undisturbed,BTFUD);(3)刚刚遭受人工连片挖掘影响的海草区(渔民使用锄头在海草床挖掘20~30 cm深,捕获其中个体较大的经济种类)(Seagrass Bed Disturbed by Newly Human Digging, SBHD-00);(4)刚刚遭受高压水枪冲击后的海草区(Seagrass Bed under Newly Pumping Disturbance, SBPP-00);(5)遭受高压水枪冲击5 d后的海草区(Seagrass Bed after 5 d Pumping Disturbance,SBPP-05)。随后进行采样,其中:
|
图 1 研究区5种生境分布照片(以大疆PHANTOM 4无人机在空中作垂直拍摄)(a)及样地布设示意图(b) Fig.1 Five photos of different habitats distribution (a)(taken by the unmanned aerial vehicle DJI PHANTOM 4 in Jan 21, 2017) and the deployment of different sampling plots (b) |
① 海草群落采样:在各个生境中随机设置9个采样点,以50 cm×50 cm的样方按SeagrassNet监测手册的方法对每个采样点进行海草覆盖率估算[11]。每个生境用直径7 cm的圆柱形采样器采集9个带沉积物样品,以50目的标准筛筛洗后,将剩余沉积物中的海草植物挑出,统计单位面积内喜盐草的直立茎数量。此外,将海草样品用纯净水冲洗干净后分为地上部分(叶片、叶柄以及花果等繁殖器官)和地下部分(根状茎与根),分别烘干至恒质量,用千分之一电子天平称量[11-12]。
② 大型底栖动物采样:每种生境内随机设置3个底栖动物采样点,每个采样点用25 cm×25 cm样方框采集3个深度为30 cm的沉积物样本。沉积物样本经0.5 mm孔径的分样筛淘洗,获取大型底栖动物样品。动物样品用体积分数为75%的酒精保存后带回实验室进行物种鉴定、计数和质量测定。
1.3 分析方法大型底栖动物优势种的优势度采用Pinkas相对重要性指数(IRI)[13],其公式为
| $ {\rm{IRI = }}\left( {\mathit{W}{\rm{\% + }}\mathit{N}{\rm{\% }}} \right){\rm{ \times }}\mathit{F}{\rm{\% }}, $ | (1) |
其中:W为该种类占总质量的百分比,N为该种类数量占总数的百分比,F为该种数出现的次数占调查总次数的百分比。
群落多样性分析采用式2)~4):
Shannon-Wiener多样性指数(H′)[14]:
| $ \mathit{H'}{\rm{ = - }}\sum {\mathit{Pi}\;\;{\rm{ln}}\;\mathit{Pi}, } $ | (2) |
Pielou均匀度指数(J′)[15]:
| $ \mathit{J'}{\rm{ = }}\mathit{H'}{\rm{/ln}}\;\;\mathit{S}, $ | (3) |
Margalef物种丰富度指数(D′)[16]:
| $ \mathit{D'}{\rm{ = }}\left( {\mathit{S}{\rm{ - 1}}} \right){\rm{/ln}}\;\mathit{N}, $ | (4) |
其中:Pi为第i种类的生物量(或个数)占总生物量(或总个数)的百分比,S为种类数,N为总个体数。
方差分析使用数理统计软件SPSS 20.0完成,以P<0.05为显著性差异,P<0.01为极显著差异。
2 结果与分析 2.1 不同干扰方式对海草群落结构的影响各种生境的海草覆盖度调查结果表明,受高压水枪冲击的海草区(SBPP-00:1.3%±0.3%;SBPP-05:0.2%±0.1%)和人工挖掘的海草区(SBUD:0.4%±0.2%),均极显著低于未受人为干扰的海草区(SBUD:14.1%±1.9%)(P<0.01)(图 2a)。各个受干扰类型之间的海草覆盖度无显著性差异,表明高压水枪及人工挖掘2种干扰方式都对海草覆盖度产生了极显著的负面影响。

|
不同生境间上面有不同字母表示有极显著性差异(P<0.01), BTFUD由于本身没有海草植物生长,没有加入到各个处理间的多重比较 Different letters indicate highly significant differences between habitats (P < 0.01), BTFUD was not included in the calculations of multiple comparisons, because there was no seagrass growing 图 2 竹林海草床各类生境的海草群落特征 Fig.2 Seagrass community characteristics among different habitats in Zhulin |
从海草的生物量来看,不管是总生物量(图 2b)、地上生物量(图 2c)或是地下生物量(图 2d),均表现为受人为干扰的海草生物量极显著低于未受干扰的海草区(P<0.01)。其中总生物量:SBUD(27.116±6.474) g/m2>SBPP-00(1.673±0.663) g/m2>SBHD-00(0.465±0.343) g/m2>SBPP-05(0.034±0.023) g/m2;地上生物量:SBUD(13.841±2.987) g/m2>SBPP-00(0.770±0.301) g/m2>SBHD-00(0.188±0.142) g/m2>SBPP-05(0.021±0.014) g/m2;地下生物量:SBUD(13.275±3.943) g/m2>SBPP-00(0.903±0.362) g/m2>SBHD-00(0.276±0.201) g/m2>SBPP-05(0.014±0.009) g/m2。各个受干扰类型之间海草生物量无显著性差异。
海草密度调查结果显示,受高压水枪冲击的海草区(SBPP-00:(247±88) shoots/m2;SBPP-05:(4±2) shoots/m2)和人工挖掘的海草区(SBHD-00:(57±39) shoots/m2),均极显著低于未受人为干扰的海草区(SBUD:(3 753±583) shoots/m2)(P<0.01)(图 2e)。各个受干扰类型之间海草密度无显著性差异,表明高压水枪及人工挖掘2种干扰方式都极显著降低了海草群落的密度。
此外,比较刚刚遭受高压水枪冲击的海草区和冲击5 d后的海草区显示,不管是枝密度、覆盖度或是生物量,均表现为SBHD-00>SBPP-05。
2.2 不同干扰方式对大型底栖动物群落结构的影响 2.2.1 不同生境的大型底栖动物种类组成情况竹林海草床共记采集到大型底栖动物22种(表 1),隶属3门4纲16科。从种类组成来看,以软体动物门种数最多,有11科17种,占采集到的物种数的77%;其次为节肢动物门,有4科4种,占总物种数的18%;环节动物门有1科1种。
| 表 1 竹林海草床大型底栖动物名录 Table 1 Species list of macrobenthos in Zhulin seagrass bed |
在未受人为干扰的海草床(SBUD)采集到的大型底栖动物种类最多,共计11科16种;其次是刚遭高压水枪冲击后的海草区(SBPP-00),共计9科12种;再次是刚刚遭受人工挖掘影响的海草区(SBHD-00),共计9科9种;未受人为干扰的裸滩(BTFUD)和遭高压水枪冲击5 d后的海草区(SBPP-05)最少,分别为7科8种和8科8种。在未受人为干扰的海草区的优势种是珠带拟蟹守螺(Cerithidea cingulata),在未受人为干扰的裸滩(BTFUD)的优势种是疏纹满月蛤(Lucina scarlatoi),其他3种受到干扰的海草区的优势种均是沙蚕(Nereis spp.)。
2.2.2 大型底栖动物多样性指数竹林海草床大型底栖动物的多样性指数情况见表 2。未受人为干扰的海草区(SBUD)多样性指数和物种丰富度指数最大,分别为1.76和3.02;多样性指数最低的是遭高压水枪冲击5 d后的海草区(SBPP-05),仅为1.04;刚遭高压水枪冲击后的海草区(SBPP-00)物种丰富度指数仅次于未受认为干扰的海草区(SBUD),为2.09;而无干扰的裸滩(STFUD)、遭高压水枪冲击5 d后的海草区(SBPP-05)和刚刚遭受人工连片挖掘影响的海草区(SBHD)的物种丰富度指数均为1.72。均匀度指数最高的是刚刚遭受人工连片挖掘影响的海草区(SBHD-00),为0.75;最低的是刚遭高压水枪冲击后的海草区(SBPP-00),仅为0.47。
| 表 2 竹林海草床大型底栖动物的多样性 Table 2 Diversity indices of the macrobenthos in Zhulin seagrass bed |
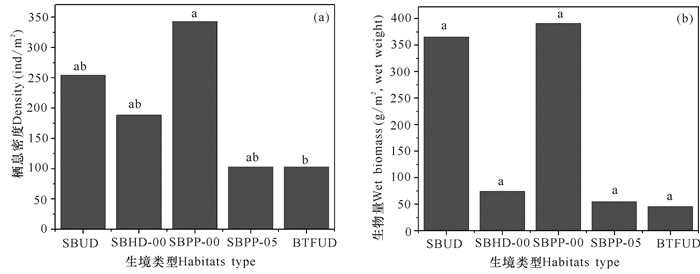
竹林海草床5种生境大型底栖动物的生物量和栖息密度调查比较中(图 3),栖息密度排序:刚刚遭受高压水枪冲击后的海草区(SBPP-00)(343.11±137.26) ind/m2>未受人为直接干扰的海草区(SBUD)(254.22±51.25) ind/m2>刚刚遭受人工连片挖掘影响的海草区(SBHD-00)(188.45±125.34) ind/m2>遭受高压水枪冲击5 d后的海草区(SBPP-05)(103.11±8.15) ind/m2=未受人为干扰的裸滩(BTFUD)(103.11±11.10) ind/m2;生物量排序:刚刚遭受高压水枪冲击后的海草区(SBPP-00)(390.92±442.93) g/m2>未受人为直接干扰的海草区(SBUD)(365.35±115.07) g/m2>刚刚遭受人工挖掘影响的海草区(SBHD-00)(74.36±63.79) g/m2>遭受高压水枪冲击5 d后的海草区(SBPP-05)(54.54±40.81) g/m2>未受人为干扰的裸滩(BTFUD)(45.72±6.62) g/m2。刚刚遭受高压水枪冲击后的海草区(SBPP-00)的栖息密度与遭受高压水枪冲击5 d后的海草区(SBPP-05)、未受人为干扰的裸滩(BTFUD)之间差异极显著(P<0.01),其他生境之间的栖息密度差异不显著;5种生境之间的生物量差异不显著。
|
图 3 竹林海草床各类生境的大型底栖动物群落特征 Fig.3 Characteristics of macrobenthos composition in various habitats of seagrass bed in Zhulin |
利用高压水枪的人为物理干扰作业方式对海草床底质(沉积物)造成了强烈的搅动。从景观的角度看,会在海草床形成了“疤痕”(图 1a),并使底质中的间隙水和沉积物颗粒充分混合,在地表上形成了黑色浑浊的水体(图 1a);从结构上看,海草植物几乎完全被搅起,并随着后续的潮汐逐渐被冲走,5个潮汐以后几乎没有任何海草植物残留,因此,最终造成海草群落的覆盖度、生物量和密度的显著降低。
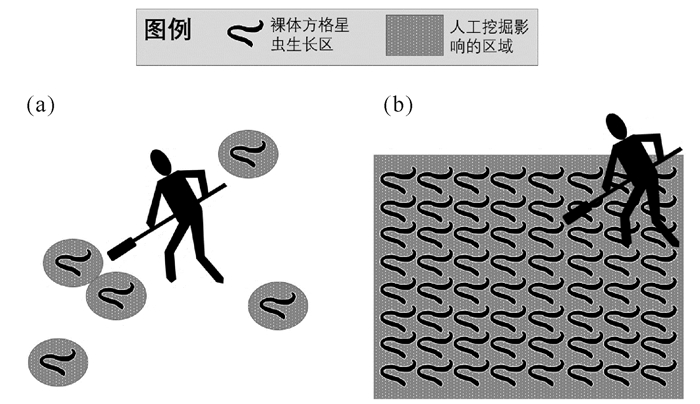
采用铁铲、锄头、耙或类似的工具进行人工挖掘滩涂经济动物有2种方式(图 4):①第一种是非连片集中式人工挖掘,用于对滩涂天然生长的经济动物的采集(图 4a)。天然经济动物的生长特点是非连续型分布,相对于人工养殖的区域,单位面积内的动物密度通常相对较低,因此单位面积作业强度相对较低,作业方式为“点”“面”结合的非连续型,所以对海草群落的影响存在较大的不确定性[17]。例如,有研究表明滩涂贝类/星虫的人工采收活动对海草群落或生长有负面影响[18-20],但是有些时候造成负面影响的主要原因是挖掘时的人为践踏而非挖掘行为本身。此外,也有研究显示海草区的人为挖掘活动对海草没有明显的负面影响[21],或者是海草能在人为干扰后快速恢复生长[22],有些情况下人为干扰甚至会促进海草的繁殖产出[23]。②第二种是集中连片式人工挖掘,即本研究所提及的人工挖掘方式,用于对滩涂养殖类经济动物的采集(图 4b)。养殖类经济动物的生长特点是密度高、分布连续,因此作业强度高,作业方式为“面”状的连片集中型,故对海草群落扰动很大,常造成海草覆盖度、密度和生物量的大量丧失。
|
(a)对天然生长的裸体方格星虫的人工挖掘;(b)对养殖类的裸体方格星虫的人工挖掘 (a)Digging on the natural economic macrobenthos; (b)Digging on the farmed economic macrobenthos 图 4 滩涂经济动物的人工挖掘2种方式的比较 Fig.4 Comparisons of two types of human digging on the economic macrobenthos in tidal flat |
以上结果表明,人为的物理干扰短期内(0~5 d)显著地改变了海草的群落结构,至于干扰的长期效应以及海草植物是否能恢复生长、多久能恢复等问题值得进一步探讨。此外,人为干扰后底质的理化特征以及微生物群落结构如何变化,也是值得深入研究的方向。
3.2 人为物理干扰减少了海草床大型底栖动物的种类数量,改变了生境的优势种在调查的5种生境中,未受人为直接干扰的海草区(SBUD)的大型底栖动物种数是未受人为干扰的裸滩(BTFUD)的2倍,可见在同一区域,海草区的大型底栖动物种类多于裸滩,可能原因在于水生植物能拦截有机颗粒碎屑,增加食物来源,稳定底质,供应氧气,提供栖息地和育苗场所[24-26]。遭受高压水枪冲击5 d后的海草区(SBPP-05)的种数与未受人为干扰的裸滩(BTFUD)相同,表明海草消失可能会导致大型底栖动物种数减少。刚刚遭受高压水枪冲击后的海草区(SBPP-00)种数比未受人为直接干扰的海草区(SBUD)少,多于其他3种生境,原因在于部分表层(0~20 cm)的大型底栖动物被冲走或冲击到较深处,但部分生存于较深的动物也被冲击到表层。刚刚遭受人工挖掘影响的海草区(SBHD-00)仅比未受人为干扰的裸滩(BTFUD)多1种,这是由于仅个体较大的经济种类被捡走,如杂色蛤仔(Ruditapes varieegata)、青蛤(Cyclina sinensis)。与未受到干扰的海草区相比,刚刚遭受人工挖掘影响的海草区(SBHD-00)、遭受高压水枪冲击5 d后的海草区(SBPP-05)优势种发生了改变,表明人为物理干扰能改变海草床大型底栖动物的结构组成。
3.3 人为物理干扰降低了海草床大型底栖动物的多样性、生物量和栖息密度未受人为直接干扰的海草区(SBUD)的Shannon-Wiener多样性指数和物种丰富度指数最高,刚刚遭受人工挖掘影响的海草区(SBHD-00)降低了0.11,而刚刚遭受高压水枪冲击后的海草区(SBPP-00)和遭受高压水枪冲击5 d后的海草区(SBPP-05)分别降低了0.60和0.72,从而反映出利用高压水枪冲击海草区对海草床大型底栖动物多样性影响比人工挖掘的大。在高压水枪冲击海草床后,随着时间的推移,大型底栖动物多样性降低的原因可能是栖息地生物多样性的下降[27]。虽然刚刚遭受人工挖掘影响的海草区(SBHD-00)的种类较多,物种丰富度指数也仅低于未受人为直接干扰的海草区(SBUD),但是由于其均匀度指数最低,因此其多样性指数较低。
刚刚遭受高压水枪冲击后的海草区(SBPP-00)的大型底栖动物生物量和栖息密度高于未受人为直接干扰的海草区(SBUD),因为在高压水枪的冲击下,很难捕捞到除了裸体方格星虫之外的其他动物。此外,可能的原因是中下层(20~80 cm)的底栖动物被冲击到表层,也可能在高压水枪的冲击下,沉积物的底质、栖息密度、溶解氧、pH值等因素均发生了变化,使大型底栖动物无法适应改变后的环境而选择往外逃逸。研究表明,底栖动物的分布与物种组成在很大程度上取决于底质的类型[28-32],而底质的粒径、稳定性、表面性质、颗粒间隙等对底栖动物的影响显著[29, 33-35]。遭受高压水枪冲击5 d的海草区(SBPP-05)栖息密度与刚刚遭受高压水枪冲击后的海草区(SBPP-00)之间差异极显著,可能的原因是被高压水枪冲击过的海草床在短暂恢复过程中,部分大型底栖动物逃逸到周边未被干扰的生境,更主要的是大型底栖动物死亡。在调查区域观察到,在刚刚遭受高压水枪冲击后的海草区(SBPP-00)或周边发现有较多的底栖动物死亡,如裸体方格星虫、尼科巴立蛤(Meropesta nicobarica)、杂色蛤仔等。底栖动物在不合适的底质上生长会受到抑制甚至死亡[36]。其死亡的原因是高压水枪冲击形成的沙浆中含有大量的沙粒,这些沙粒会堵塞软体动物的外套腔和鳃,从而导致这些动物的死亡[18],而海草床的软体动物占总大型底栖动物种数的75%以上。未受人为直接干扰的海草区(SBUD)的大型底栖动物生物量和栖息密度均高于未受人为干扰的裸滩(BTFUD),可见海草有利于大型底栖动物的生长。刚刚遭受人工挖掘影响的海草区(SBHD-00)的生物量和栖息密度低于未受人为直接干扰的海草区(SBUD)又高于遭受高压水枪冲击5 d后的海草区(SBPP-05),原因在于人工挖掘仅带走个体较大的经济种。此外人工挖掘深度较浅,底质改变较小,留存下来的大型底栖动物伤害较小,因此人工挖掘对大型底栖动物的初期影响比用高压水枪冲击滩涂小,但对人工挖掘和高压水枪冲击的后期恢复状况还有待深入研究。
4 结论使用高压水枪以及连片集中式的人工挖掘方式在海草区采集滩涂经济动物的人为物理干扰短期内显著地改变了海草床的群落结构,对海草群落有较大的负面生态影响;人为物理干扰改变了海岸带生态系统(海草床和裸滩)大型底栖动物的群落结构,改变了生境的优势种,降低了海草床内大型底栖动物的多样性、生物量和栖息密度,短期内对大型底栖动物有显著的负面生态影响;人为物理干扰对海草群落和底栖动物群落的长期生态效应有待进一步的监测研究。
| [1] |
HEMMINGA M A, DUARTE C M. Seagrass ecology[M]. Cambridge: Cambridge University Press, 2000.
|
| [2] |
ORTH R J, CARRUTHERS T J B, DENNISON W C, et al. A global crisis for seagrass ecosystems[J]. Bioscience, 2006, 56(12): 987-996. DOI:10.1641/0006-3568(2006)56[987:AGCFSE]2.0.CO;2 |
| [3] |
LARKUM A W D, ORTH R J, DUARTE C M. Seagrasses:Biology, ecology, and conservation[M]. Netherlands: Springer, 2006.
|
| [4] |
BLANCHET H, DE MONTAUDOUIN X, LUCAS A, et al. Heterogeneity of macrozoobenthic assemblages within a Zostera noltii seagrass bed:Diversity, abundance, biomass and structuring factors[J]. Estuarine, Coastal and Shelf Science, 2014, 61(1): 111-123. |
| [5] |
ORTH R J, HECK K L, VAN MONTFRANS J. Faunal communities in seagrass beds:A review of the influence of plant structure and prey characteristics on predator:Prey relationships[J]. Estuaries, 1984, 7(4): 339-350. DOI:10.2307/1351618 |
| [6] |
雷丹青, 李肖肖, 廖共山. 广西沿海裸体方格星虫纤维蛋白溶解酶的研究[J]. 天然产物研究与开发, 2013, 25(7): 897-902. LEI D Q, LI X X, LIAO G S. Study of fibrinolytic enzyme from Sipunculus nudus Linnaeus in Guangxi coastal area[J]. Natural Product Research and Development, 2013, 25(7): 897-902. |
| [7] |
殷虹, 施培佳, 莫芸迪. 浅析沿海滩涂的法律保护——以广西北海银滩镇高压水枪挖掘沙虫事件为例[J]. 法制博览, 2016(13): 198-199. YIN H, SHI P J, MO Y D. Legislation protection of tidal flat-Case of using pumping method for harvesting Sipunculus in Yintan Town, Beihai, Guangxi[J]. Legality Vision, 2016(13): 198-199. DOI:10.3969/j.issn.2095-4379.2016.13.112 |
| [8] |
岑仁勇. 加大执法力度保护海域滩涂[N]. 北海日报, 2014-12-29(001). CEN R Y.Strengthen law enforcement and protect the tidal flat[N]. Beihai Daily, 2014-12-29(001). |
| [9] |
邱广龙. 全球海草监测站落户北海[N]. 北海日报, 2008-07-24(001). QIU G L.Beihai joins the Global Seagrass Monitoring Net (SeagrassNet)[N]. Beihai Daily, 2008-07-24(001). |
| [10] |
赵彩云, 柳晓燕, 白加德, 等. 广西北海西村港互花米草对红树林湿地大型底栖动物群落的影响[J]. 生物多样性, 2014, 22(5): 630-639. ZHAO C Y, LIU X Y, BAI J D, et al. Impact of Spartina alterniflora on benthic macro-invertebrates communities on mangrove wetland in Xicungang Estuary, Guangxi[J]. Biodiversity Science, 2014, 22(5): 630-639. |
| [11] |
SHORT F T, MCHENZIE L J, COLES R G, et al. SeagrassNet manual for scientific monitoring of seagrass habitat (Worldwide edition)[M]. Durham, New Hampshire: University of New Hampshire Publication, 2006.
|
| [12] |
邱广龙, 范航清, 李宗善, 等. 濒危海草贝克喜盐草的种群动态及土壤种子库研究——以广西珍珠湾为例[J]. 生态学报, 2013, 33(19): 6163-6172. QIU G L, FAN H Q, LI Z S, et al. Population dynamics and seed banks of the threatened seagrass Halophila beccarii in Pearl Bay, Guangxi[J]. Acta Ecologica Sinica, 2013, 33(19): 6163-6172. |
| [13] |
PIANKA E R. Ecology of the agamid lizard Amphibolurus isolepis in Western Australia[J]. Copeia, 1971(3): 527-536. |
| [14] |
SHANNON C E, WEAVER W. The mathematical theory of communication[M]. Urbanna: University of Illinois Press, 1949.
|
| [15] |
PIELOU E C. Ecological diversity[M]. New York: John Wiley & Sons, 1975.
|
| [16] |
MARGALEF R. Perspectives in ecological theory[M]. Chicago: University of Chicago Press, 1968.
|
| [17] |
FONSECA M S, KENWORTHY W J, THAYER G W.Guidelines for the conservation and restoration of seagrasses in the United States and adjacent waters[M]. NOAA Coastal Ocean Program Decision Analysis Series, 12.Maryland:NOAA Coastal Ocean Office, 1998:222.
|
| [18] |
CABAÇO S, ALEXANDRE A, SANTOS R. Population-level effects of clam harvesting on the seagrass Zostera noltii[J]. Marine Ecology Progress Series, 2005, 298: 123-129. DOI:10.3354/meps298123 |
| [19] |
ETXANDI J M G, VALLE M, BORJA A, et al. , Effect of trampling and digging from shellfishing on Zostera noltei (Zosteraceae) intertidal seagrass beds[J]. Scientia Marina, 2017, 81(1): 121-128. DOI:10.3989/scimar.2017.81n1 |
| [20] |
NECKLES H A, SHORT F T, BARKER S, et al. Disturbance of eelgrass Zostera marina by commercial mussel Mytilus edulis harvesting in Maine:Dragging impacts and habitat recovery[J]. Marine Ecology Progress Series, 2005, 285: 57-73. DOI:10.3354/meps285057 |
| [21] |
BOESE B L. Effects of recreational clam harvesting on eelgrass (Zostera marina) and associated infaunal invertebrates:In situ manipulative experiments[J]. Aquatic Botany, 2002, 73(1): 63-74. DOI:10.1016/S0304-3770(02)00004-9 |
| [22] |
PARK S R, KIM Y K, KIM J H, et al. Rapid recovery of the intertidal seagrass Zostera japonica following intense Manila clam (Ruditapes philippinarum) harvesting activity in Korea[J]. Journal of Experimental Marine Biology and Ecology, 2011, 407(2): 275-283. DOI:10.1016/j.jembe.2011.06.023 |
| [23] |
ALEXANDRE A, SANTOS R, SERRÃO E. Effects of clam harvesting on sexual reproduction of the seagrass Zostera noltii[J]. Marine Ecology Progress Series, 2005, 298: 115-122. DOI:10.3354/meps298115 |
| [24] |
COSTANZAA R, D'ARGEC R, DEGROOTD R, et al. The value of the world's ecosystem services and natural capital[J]. Nature, 1997, 387(6630): 253-260. DOI:10.1038/387253a0 |
| [25] |
胡勇军, 孙刚, 韩德复. 长春南湖水生生态系统的初级生产(Ⅰ):浮游植物[J]. 东北师大学报:自然科学版, 2001, 33(2): 80-83. HU Y J, SUN G, HAN D F. Primary production of the Nanhu Lake aquatic ecosystem in Changchun(Ⅰ):Phytoplankton[J]. Journal of Northeast Normal University:Natural Science, 2001, 33(2): 80-83. |
| [26] |
房岩, 韩德复, 刘倩, 等. 长春南湖水体生物能量的垂直分布格局[J]. 长春师范学院学报:自然科学版, 2011, 30(5): 56-58. FANG Y, HAN D F, LIU Q, et al. Vertical distribution pattern of biotic energy in the nanhu lake waterbody of Changchun[J]. Journal of Changchun Teachers College:Natural Science, 2011, 30(5): 56-58. |
| [27] |
段学花, 王兆印, 徐梦珍. 底栖动物与河流生态评价[M]. 北京: 清华大学出版社, 2010. DUAN X H, WANG Z Y, XU M Z. Benthic macroinvertebrate and application in the assessment of stream ecology[M]. Beijing: Tsinghua University Press, 2010. |
| [28] |
EVANS L, NORRIS R. Prediction of benthic macroinvertebrate composition using microhabitat characteristics derived from stereo photography[J]. Freshwater Biology, 1997, 37(3): 621-633. DOI:10.1046/j.1365-2427.1997.00188.x |
| [29] |
BUSS D F, BAPTISTA D F, NESSIMIAN J L, et al. Substrate specificity, environmental degradation and disturbance structuring macroinvertebrate assemblages in neotropical streams[J]. Hydrobiologia, 2004, 518(1/2/3): 179-188. |
| [30] |
BEAUGER A, LAIR N, REYES-MARCHANT P, et al. The distribution of macroinvertebrate assemblages in a reach of the river allier (france), in relation to riverbed characteristics[J]. Hydrobiologia, 2006, 571(1): 63-76. DOI:10.1007/s10750-006-0217-x |
| [31] |
BEISEL J N, USSEGLIOPO-LATERA P, THOMAS S, et al. Stream community structure in relation to spatial variation:The influence of mesohabitat characteristics[J]. Hydrobiologia, 1998, 389(1/2/3): 73-88. |
| [32] |
ARUNACHALAM M, NAIR K C M, VIJVERBERG J, et al. Substrate selection and seasonal variation in densities of invertebrates in stream pools of a tropical river[J]. Hydrobiologia, 1997, 213(2): 141-148. |
| [33] |
GRAÇA M A S, PINTO P, CORTES R, et al. Factors affecting macroinvertebrate richness and diversity in portuguese streams:A two-scale analysis[J]. International Review of Hydrobiology, 2004, 89(2): 151-164. DOI:10.1002/(ISSN)1522-2632 |
| [34] |
FLECKER A S, ALLAN J D. The importance of predation, substrate and spatial refugia in determining lotic insect distributions[J]. Oecologia, 1984, 64(3): 306-313. DOI:10.1007/BF00379126 |
| [35] |
DOWNES B J, LAKE P S, SCHREIBER E S G, et al. Habitat structure, resources and diversity:The separate effects of surface roughness and macroalgae on stream invertebrates[J]. Oecologia, 2000, 123(4): 569-581. DOI:10.1007/PL00008862 |
| [36] |
何志辉. 淡水生态学[M]. 北京: 中国农业大学出版社, 2004. HE Z H. Freshwater ecology[M]. Beijing: China Agricultural University Press, 2004. |
 2017, Vol. 24
2017, Vol. 24 


