2. 广西科学院,广西 南宁 530007;
3. 广西大学农学院,广西 南宁 530004
2. Guangxi Academy of Sciences, Nanning, Guangxi, 530007, China;
3. College of Agriculture, Guangxi University, Nanning, Guangxi, 530004, China
【研究意义】芽孢是部分细菌在遇到不良生长条件时形成的休眠体。由于含水量极低,而且富含2,6-吡啶二羧酸与钙离子结合形成的CaDPA络合物(约占细胞干重10%),再加上孢外厚厚的芽孢衣,芽孢对辐射、高温、干燥、极端pH值、静水压和一些有毒化学品等有很强的抵抗能力,是细菌的一种生存策略[1-2]。另外,芽孢内核富含的一组小的酸溶性蛋白质(Small acid soluble proteins)也对DNA起保护作用[3]。由于芽孢的强抗逆能力,常规的灭菌方法如巴氏灭菌、熏蒸灭菌、煮沸灭菌无法将细菌芽孢彻底杀灭,而采用高温高压或者一些物理手段如紫外线来灭菌,可能对灭菌对象(如器械、食品等)产生破坏或者受条件限制无法实施。对于细菌芽孢的控制,一方面是设法让芽孢萌发使其失去各种抗性,然后使用常规的方法将其灭杀;或者是设法抑制或者破坏芽孢的萌发,使其无法萌发或者无法进一步生长。因此了解芽孢的抗性,了解杀菌剂对芽孢的杀灭机理,对寻找更为有效合理的芽孢杀灭方法有重要意义。【前人研究进展】已有大量的文献报道如何杀灭细菌芽孢及其杀灭机制,包括辐射、热处理和各种化学药剂[1],其中杀灭芽孢的化学药剂种类繁多,应用广泛[4]。强碱类物质不是常用的、直接的消毒剂,但通常以一定比例出现消毒剂中。萌发是芽孢进一步繁殖生长的重要起点,与萌发相关的任何途径或者部件受损芽孢就可能无法萌发而失去繁殖能力。芽孢既可以由营养萌发剂来触发,也可由非营养性物质或物理因素来触发,萌发剂受体、CaDPA释放通道蛋白、皮层水解酶等参与其中[5-7]。通过观察处理后的芽孢萌发过程,可以了解到各种灭菌措施或化学药剂杀灭活芽孢的机制。拉曼光谱是一种分子振动光谱,具有实时、快速、无损分析的优势,可以提供丰富的分子结构和组成信息,在生物医学及微生物单细胞分析领域有广泛的应用[8-9]。多细胞实时微分干涉差(Differential interference contrast,DIC)显微镜术实现了单细胞水平高通量分析单个细菌芽孢的萌发动态,对认识芽孢的萌发机制起到很大的促进作用[7, 10-12]。苏云金芽孢杆菌(Bacillus thuringiensis,简称Bt)具有独特的杀虫特性,能高效灭杀鳞翅目幼虫而对哺乳动物几乎无害,是目前应用最广泛、生产规模最大的微生物杀虫剂[13-14]。Bt与蜡状芽孢杆菌(B.cereus)、炭疽芽孢杆菌(B.anthracis)虽在宿主范围以及对农业和人类健康的影响方面有很大差异,但是在遗传上十分相近[15]。已有文献从群体水平报道强碱对枯草芽孢杆菌(B.subtilis)芽孢萌发的影响,认为强碱并不直接杀灭芽孢,而是使皮层水解酶失活,从而使芽孢无法萌发[16],但没有在单细胞水平上展开研究,无法了解具体的芽孢萌发细节,也不清楚碱处理对芽孢的其它组件是否产生影响。【本研究切入点】应用单细胞拉曼光谱分析NaOH处理后的单个Bt芽孢孢内主要成分和结构的变化,应用实时DIC显微镜从单细胞水平监测NaOH处理后Bt芽孢的萌发动态和萌发参数。【拟解决的关键问题】追踪分析经NaOH处理后的单个Bt芽孢在不同萌发剂触发下的萌发动态,获知NaOH处理对Bt芽孢与芽孢萌发的影响,从单细胞水平进一步了解强碱类物质对芽胞的杀灭机制。
1 材料与方法 1.1 实验菌株及培养基菌株:苏金云芽孢杆菌(B.thuringiensis)HD-1菌株,HD-1为库斯塔克亚种,购自中国普通微生物菌种保藏中心,编号为AS 1.1014。
种子培养基(LB):蛋白胨10 g/L,酵母提取物5 g/L,NaCl 10 g/L,pH值7.4~7.6。
液体培养基(CCY):谷氨酰胺20 mg,酸水解干酪素1 g,酶水解干酪素1 g,酵母提取物0.4 g,甘油0.6 g,去离子水定容至1 000 mL,在定容前添加以下终浓度的微量元素:MgCl2·6H2O 0.5 mmol/L,MnCl·4H2O 0.01 mmol/L,FeCl3·6H2O 0.05 mmol/L,ZnCl2 0.05 mmol/L,CaCl2·6H2O 0.2 mmol/L,KH2PO4 13 mmol/L,K2HPO4 26 mmol/L。121℃,20 min灭菌。
1.2 芽胞制备菌株在LB固体培养基活化24~36 h,挑取单菌落,转接入LB液体培养基,200 r/min过夜培养,取1%菌液转入产孢培养基(CCY),200 r/min,培养48~60 h。上述培养过程均在30℃下进行。镜检芽孢率达到99%后,5 000 r/min离心10 min收集、纯化芽孢,无菌水洗涤10次。最后用无菌水悬浮,4℃保存备用。
1.3 NaOH处理与芽孢萌发 1.3.1 芽孢NaOH处理取OD600=10.0的Bt HD-1芽孢0.2 mL,5 000 r/min离心10 min,去上清,加入1 mL 1.0 mol/L的NaOH,25℃下处理30 min、45 min或者60 min;常温下8 000 r/min离心2 min,去掉上清部分,加入2.0 mL 50 mmol/L磷酸盐缓冲液(pH值为7.4) 中和,无菌去离子水洗3次。用0.1 mL无菌水悬浮后放4℃冰箱保存备用。用无菌去离子水代替NaOH做同样处理,作为对照。
1.3.2 芽孢存活率的测定将处理过的芽孢稀释10-3~10-6倍,吸取0.1 mL均匀涂布在LB培养基平板上,每个梯度3个平板,30℃暗培养24~36 h,选择50~300个菌落范围内的平板计数,统计NaOH处理后能在LB培养基上形成的菌落数,以不处理的芽孢为对照,计算能长成菌落的芽孢培养率,作为芽孢的存活率。
1.3.3 拉曼数据采集本实验室自主搭建激光光镊拉曼光谱系统,如Xie等[17-18]所描述。将波长780 nm的激光束导入倒置显微镜(TE2000U,Nikon),激光光束经油镜聚焦,形成光势阱来捕获细胞,成像聚焦进光谱仪并被CCD检测。用聚苯丙乙烯微球(直径约2.0 μm)进行系统校正。
芽孢悬浮于无菌水中,放入样品槽内,在100倍显微镜物镜下,光镊随机捕获单个芽孢,收集目标芽孢拉曼光谱,信号积累时间为10 s,每个样品收集50个光谱,5个背景光谱。单个芽孢光谱经系统系数校正,减去背景并经5点相邻平滑,用Matlab自编程序读取1 017 cm-1峰的总面积。
1.3.4 芽孢萌发实时观测待分析的Bt芽孢用无菌水稀释为108个芽孢/mL,经70℃水浴30 min、0℃冰浴15 min热激处理,吸取2 μL菌液滴加在盖玻片上,真空干燥,将盖玻片固定在自制的恒温平台上,加入预热好的萌发剂。对DIC显微镜(Olympus IX81) 加以改造,接入高性能CCD,实现实时监测芽孢萌发过程[12]。根据实验需要,每6 s采集一幅DIC图像,持续观察60~120 min。
监测以下几个方面的芽孢萌发:(1) 营养萌发, 50 mmol/L丙氨酸和25 mmol/L Hepes缓冲液(pH值为7.4),37℃萌发;(2) 非营养萌发, 45 mmol/L CaDPA,30℃;或者0.8 mmol/L月桂胺和25 mmol/L Hepes缓冲液(pH值为7.4),45℃。CaDPA触发的芽孢不需要热激处理。
细菌芽孢的萌发过程经历3个阶段,通过DIC成像方法可以很直观地观察到芽孢萌发的这3个进程[11-12]。将CaDPA开始快速释放的时间、完全释放的时间点和肽聚糖皮层完全水解的时间点分别定义为Tlag、Trelease和Tlys,则CaDPA快速释放所需要的时间△Trelease=Trelease-Tlag,皮层水解所需时间△Tlys=Tlys-Trelease,将Tlag、Trelease时对应的芽孢相对亮度定义为Ilag、Irelease(以加入萌发剂时的初始亮度为100%,以萌发结束后20 min的亮度为0,参见结果部分和文献[12])。
2 结果与分析 2.1 NaOH处理对Bt芽孢的影响虽然在日常生活中较少用强碱作为杀菌剂,但强碱还是杀灭芽胞的有效手段。图 1显示,1.0 mol/L NaOH处理一定时间后绝大多数的芽孢都失去了活力,30 min、45 min和60 min后Bt芽孢的可培养率分别为25.0%、3.6%和1.8%左右。拉曼光谱数据显示,NaOH处理后芽孢吡啶二羧酸(DPA)的特征峰1 017 cm-1峰和蛋白质的特征峰1 650~1 670 cm-1的峰强度仅有微弱的降低,芽孢内部的DPA极少泄漏,和Setlow等[16]的发现基本相同。而蛋白质二级结构α螺旋特征峰(1 280/1 652 cm-1)的位置和信号并没有明显的改变。图 2是Bt芽孢的拉曼光谱,其中662 cm-1,825 cm-1,1 017 cm-1,1 397 cm-1和1 572 cm-1是源自CaDPA的典型特征峰,而1 652 cm-1是来自蛋白质酰胺Ⅰ的二级结构α螺旋[19-20]。图中显示,即使是处理60 min的芽孢,除因为少量CaDPA泄漏而导致的拉曼光谱信号减弱外,蛋白质峰,特别是1 652 cm-1峰的强度和位置并没有明显的改变,说明NaOH处理并没有导致芽孢内蛋白质结构发生明显改变。
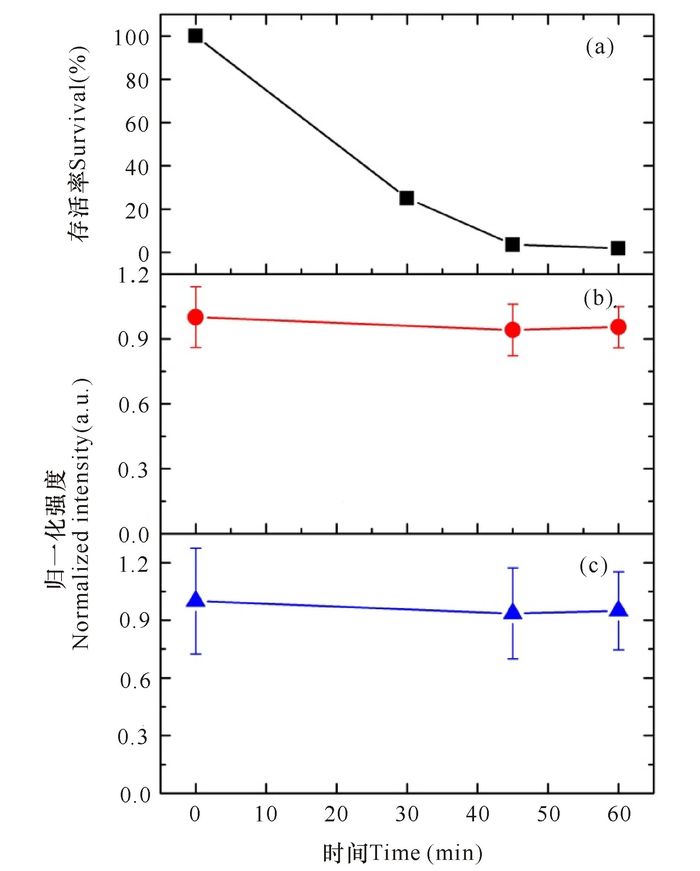
|
(a)芽孢存活率;(b)蛋白质特征峰(1 650~1 670 cm-1);(c)CaDPA特征峰(1 017 cm-1) (a)Survival of NaOH-treated spores; (b)Raman bands from proteins (1 650~1 670 cm-1); (c) Raman bands from CaDPA(1 017 cm-1) 图 1 NaOH处理后Bt芽孢的存活率及拉曼峰的平均信号强度 Fig.1 Survival of Bt spores and averaged intensities of Raman bands |
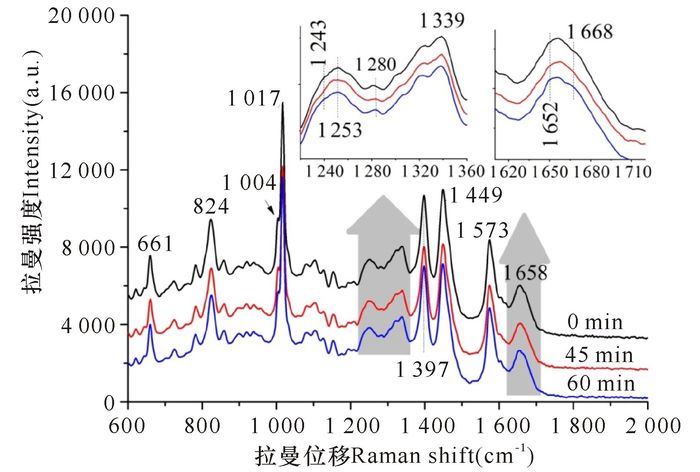
|
图 2 NaOH处理后单个Bt芽孢的平均拉曼光谱 Fig.2 Raman spectra of individual B.thuringiensis HD-1 spores |
拉曼光谱数据显示NaOH处理后的芽孢蛋白质的二级结构并没有发生显著的变化,但其存活率却显著降低,预示着强碱处理影响到芽孢的萌发能力。图 3a是处理后的芽孢在50 mmol/L丙氨酸触发下的群体萌发曲线,图中显示多数对照芽孢在20 min内萌发,而NaOH处理严重影响Bt芽孢的萌发,萌发缓慢,NaOH溶液处理30 min、45 min和60 min后,芽孢在其120 min观察期内的萌发率依次为64.4%、52.8%和50.7%左右。
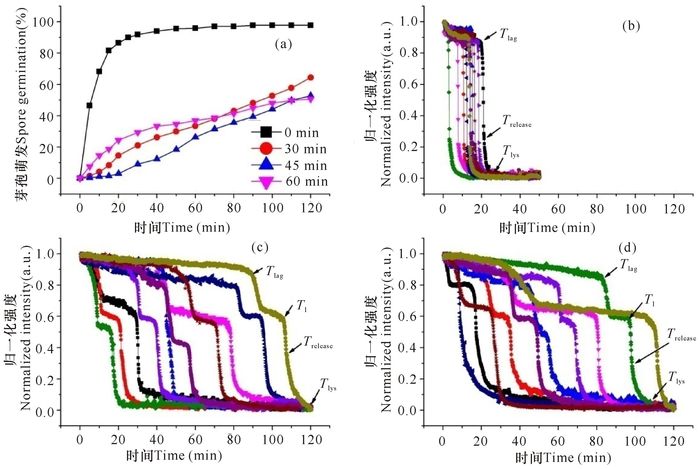
|
(a)萌发曲线;(b)对照;(c)NaOH处理30 min;(d)NaOH处理60 min (a)Spore germination curves; (b)Contrast; (c)Treated with NaOH for 30 min; (d)Treated with NaOH for 60 min 图 3 NaOH处理后Bt芽胞的丙氨酸萌发曲线及单个芽胞的萌发动态 Fig.3 L-alanine germination of alkali-treated Bt spores(a) and germination kinetic of 10 individual spores(b~d) |
图 3b~c显示单个芽孢的萌发动态,没有经过NaOH处理的芽孢萌发极其快速,每个芽孢的萌发动态曲线基本类似;萌发参数显示(表 1),CaDPA快速释放的启动时间(Tlag)仅为9 min左右,CaDPA快速释放所需的时间(ΔTrelease)约为1.3 min左右。然而处理后的芽孢,Tlag和ΔTrelease值显著增加,分别是对照的3.5~5倍和12~13倍;芽孢皮层水解所需要的时间(ΔTlys值)也增加,是对照的1.5~2倍。不同处理时间的ΔTrelease值基本接近,随着处理时间的延长而有升高趋势。值得关注的是CaDPA释放的过程,即ΔTrelease值,单个芽孢的动态曲线显示碱处理芽孢Tlag后的CaDPA释放普遍存在两个阶段,即图中Tlag~T1和T1~Trelease阶段。定义快速释放的第二个阶段的开始时间为T1,相应的芽孢相对亮度为I1,ΔT1=Trelease-T1。显然,Tlag~T1阶段明显长于T1~Trelease阶段,前者约是后者的6倍。参数Ilag和I1,是Tlag和T1时芽孢的相对亮度,它的大小间接反映Tlag和T1时孢内的CaDPA含量[21]。进一步分析发现,在Tlag前已有15%~20%的CaDPA释放到孢外,而Tlag~T1阶段释放的CaDPA约为整个萌发过程的34%~37%,T1~Trelease阶段为44%~52%,显然主要的CaDPA是在T1~Trelease阶段(2.3 min左右)释放的。上述结果表明,NaOH处理显著影响Bt HD-1芽孢的营养萌发。
2.2.2 非营养萌发测试CaDPA和月桂胺等非营养萌发剂触发的芽孢萌发,结果发现外源CaDPA无法触发NaOH处理后的Bt芽孢,而对照芽孢却萌发极其快速,98%的芽孢在20 min内萌发(图 4a)。月桂胺触发的芽孢萌发与丙氨酸触发的萌发类似,NaOH处理30 min的芽孢在其120 min观察期内的萌发率仅20%左右,处理60 min的芽孢几乎都不萌发(图 4b)。单个芽孢的动态曲线显示,NaOH处理的芽孢其Tlag后CaDPA释放也普遍存在两个阶段(图 4d)。处理30 min的芽孢,Tlag和ΔTrelease值是对照的4倍和11倍左右,Tlag~T1阶段释放的CaDPA约为整个萌发过程的40%左右,T1~Trelease阶段为30%左右(表 2)。
| 表 1 NaOH处理不同时间后Bt芽孢在丙氨酸触发下的萌发参数(平均值±标准差) Table 1 Germination parameters of alkali-treated B.thuringiensis spores triggered by 50 mol/L L-alanine(mean±standard deviation) |
| 表 2 NaOH处理不同时间后Bt芽孢在月桂胺触发下的萌发参数(平均值±标准差) Table 2 Germination parameters of NaOH-treated B.thuringiensis spores with 0.8 mmol/L dodecylamine(mean±standard deviation) |
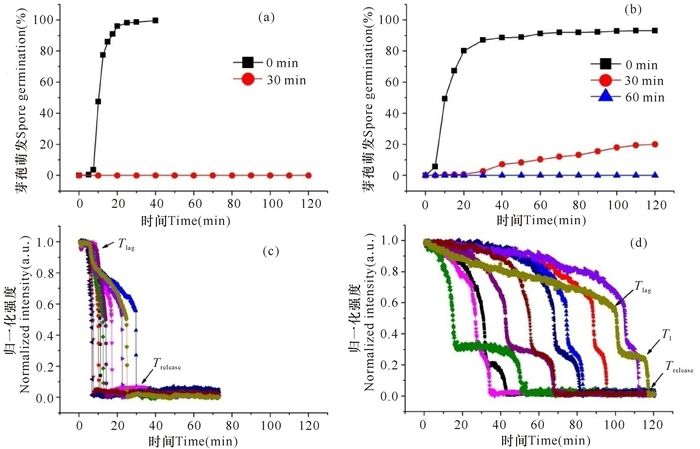
|
(a)CaDPA萌发; (b)月桂胺萌发;(c)对照;(d)NaOH处理30 min (a)CaDPA germination; (b)Dodecylamine germination; (c)Contrast; (d)Treated with NaOH for 30 min 图 4 Bt芽胞的非营养萌发(a,b)及单个芽胞的月桂胺萌发动态(c,d) Fig.4 Non-nutrient germination of alkali-treated Bt spores (a, b) and germination kinetic of 10 individual spores(c, d) |
苏金云芽孢杆菌对强碱有较强的抵抗能力,即使是1.0 mol/L NaOH处理60 min仍然有约2%左右的芽孢能在LB培养基平板上形成菌落。但拉曼光谱显示,与CaDPA和蛋白质相关峰的位置并没有明显改变,只是强度有微弱的降低,与湿热处理明显不同,后者引起与芽孢蛋白质二级结构相关的1 220~1 290 cm-1和1 620~1 680 cm-1峰强度和位置的改变[21]。虽然拉曼光谱数据显示蛋白质二级结构没有明显的改变,但NaOH处理后芽孢的萌发受到严重的影响。
芽孢萌发的几个阶段,都与相关蛋白质有关联。第一个阶段的相关蛋白是感受营养萌发剂的萌发剂受体如GerA、GerB、GerK等和传递萌发信号的GerC、GerD等蛋白[7]。Tlag值是芽孢接触到萌发剂到开始大量快速释放DPA的时间,影响Tlag值的因素包括热激活、单个芽孢上萌发剂受体的数量和萌发剂的浓度[20]。在相同的萌发条件下,造成NaOH处理后芽孢营养萌发的Tlag值显著增加的可能原因是芽孢上能感受到萌发剂的受体蛋白数量减少,亦即NaOH可能令部分萌发剂受体受损、失去功能。
芽孢在接收到萌发信号后,经过相关的信号传递(其传递机制尚未明了)后,打开芽孢内膜上的CaDPA释放通道,引起CaDPA快速释放。这是个独立过程,与萌发剂浓度、受体蛋白数量和热激活无关[22]。目前已知的相关蛋白是SpoVA。SpoVA蛋白是孢子形成时摄取CaDPA的关联蛋白,与芽孢萌发过程中的CaDPA的释放也有关联[23]。图 3和表 1的萌发参数显示,NaOH处理后,多数芽孢的CaDPA的快速释放变成两个阶段,ΔTrelease值几乎增加10倍,但是随着NaOH处理时间的增加,ΔTrelease值并没有显著增加,说明NaOH处理可能损伤Bt芽孢上与CaDPA释放有关的通道以及相关的蛋白。
月桂胺是一种表面活性剂,其萌发机制是直接或者间接打开芽孢内膜的CaDPA释放通道,引起DPA和孢内小分子释放,和萌发剂受体和芽孢皮层水解酶没有关系,但芽孢不会进一步形成营养细胞[24-25]。经NaOH处理后的芽孢,月桂胺萌发和营养萌发基本类似,进一步证明NaOH处理可能损伤了与CaDPA释放有关的通道以及相关的蛋白。
Ilag是Tlag时芽孢的相对亮度,间接反映Tlag时孢内CaDPA含量[21]。考察单个芽孢的萌发动态显示(图 3c~d),NaOH处理后的芽胞Ilag值低于对照芽胞,这和经湿热处理的芽孢萌发动态类似[21],说明Tlag前已经有一定量的CaDPA缓慢地释放出来,约为15%~20%,而对照为8%左右。在月桂胺萌发中,Tlag前释放的CaDPA更多,达到30%左右,这些数据从另一个角度说明NaOH处理对CaDPA释放通道以及相关的蛋白产生影响。
芽胞皮层肽聚糖水解是芽孢萌发的另一个关键事件,只有随着皮层的水解,芽胞才能吸水更多的水分并逐渐膨胀变大,进而最终完成萌发进程形成营养细胞。此外,外源CaDPA触发的芽胞萌发首先通过激活芽胞衣上的皮层水解酶CwlJ,进而触发孢内的CaDPA释放。因此一旦皮层水解酶CwlJ受损,外源CaDPA就无法触发芽孢的萌发。图 4a显示NaOH处理30 min后Bt芽孢在120 min内没有萌发,说明NaOH处理令CwlJ酶完全失去功能,这应当是NaOH令芽孢失活的主要原因。表 1的数据还显示,在营养萌发中,NaOH处理令芽孢萌发的ΔTlys值明显增加,约为对照的1.5~2倍,说明NaOH对另一种皮层水解酶SleB也产生严重影响。
从上述的分析我们知道碱处理并没有破坏Bt芽孢的内膜,也未造成孢内CaDPA的过多外泄,对芽孢蛋白质的二级结构影响也不显著,这可能是得益于CaDPA对芽孢的保护作用[26]。NaOH处理60 min后98%以上的芽孢已经不能在营养培养基上形成菌落(图 1a),但多数芽孢在丙氨酸触发下仍能完成孢内CaDPA的释放过程,虽然萌发缓慢(图 3)。因此,NaOH处理对芽胞的营养萌发剂受体的功能损伤并不严重,受损最严重的是皮层水解酶,其次是DPA释放通道及相关蛋白。
4 结论利用光镊拉曼技术分析NaOH处理对Bt芽孢的影响,并用DIC显微镜成像技术对芽孢的萌发过程进行监测,结果发现NaOH并没有破坏Bt芽孢的内膜,蛋白质的二级结构变化不明显。1.0 mol/L NaOH处理30~60 min后75%以上的芽孢无法形成新的菌落,而50%以上的芽孢能在丙氨酸的触发下萌发,但不能在外源CaDPA触发下萌发。因此,NaOH对参与芽胞萌发的重要相关蛋白质都有破坏作用,受损最严重的是皮层水解酶,其次是DPA释放通道及相关蛋白。
| [1] |
SETLOW P. Spores of Bacillus subtilis: Their resistance to and killing by radiation, heat and chemicals[J]. Journal of Applied Microbiology, 2006, 101(3): 514-525. DOI:10.1111/jam.2006.101.issue-3 |
| [2] |
SETLOW P. Spore resistance properties[J]. Microbiology Spectrum, 2014, 2(5). DOI:10.1128/microbiolspec |
| [3] |
SETLOW P. I will survive:Protecting and repairing spore DNA[J]. Journal of Bacteriology, 1992, 174(9): 2737-2741. DOI:10.1128/jb.174.9.2737-2741.1992 |
| [4] |
RUSSELL A D. The bacterial spores and chemical sporicidal agents[J]. Clinical Microbiology Reviews, 1990, 3(2): 99-119. DOI:10.1128/CMR.3.2.99 |
| [5] |
MOIR A. How do spores germinate?[J]. Journal of Applied Microbiology, 2006, 101(3): 526-530. DOI:10.1111/jam.2006.101.issue-3 |
| [6] |
SETLOW P. Spore germination[J]. Current Opinion in Microbiology, 2003, 6(6): 550-556. DOI:10.1016/j.mib.2003.10.001 |
| [7] |
SETLOW P. Summer meeting 2013—When the sleepers wake:The germination of spores of Bacillus species[J]. Journal of Applied Microbiology, 2013, 115(6): 1251-1268. DOI:10.1111/jam.2013.115.issue-6 |
| [8] |
PETRY R, SCHMITT M, POPP J. Raman spectroscopy-A prospective tool in the life sciences[J]. Chemphyschem, 2003, 4(1): 14-30. DOI:10.1002/cphc.v4:1 |
| [9] |
HUANG W E, LI M Q, JARVIS R M, et al. Shining light on the microbial world:The application of Raman microspectroscopy[J]. Advances in Applied Microbiology, 2010, 70: 153-186. DOI:10.1016/S0065-2164(10)70005-8 |
| [10] |
陈越, 王璐玮, 陶站华, 等. 光学技术的创新应用:细菌芽孢萌发机理研究[J]. 激光与光电子学进展, 2015, 52(10): 100002. CHEN Y, WANG L W, TAO Z H, et al. Novel application of optical techniques:Revealing the mechanism of germination of bacterial spores[J]. Laser & Optoelectronics Progress, 2015, 52(10): 100002. |
| [11] |
ZHANG P F, KONG L B, WANG G W, et al. Combination of raman tweezers and quantitative differential interference contrast microscopy for measurement of dynamics and heterogeneity during the germination of individual bacterial spores[J]. Journal of Biomedical Optics, 2010, 15(5): 56010. DOI:10.1117/1.3494567 |
| [12] |
陈越, 彭立新, 王晓春, 等. 微分干涉差显微成像方法高通量分析单个苏金云芽孢杆菌HD-1芽孢萌发[J]. 分析化学, 2015, 43(12): 1787-1793. CHEN Y, PENG L X, WANG X C, et al. High-throughput investigation of germination of individual Bacillus thuringiensis HD-1 spores by differential interference contrast microscopy imaging[J]. Chinese Journal of Analytical Chemistry, 2015, 43(12): 1787-1793. DOI:10.11895/j.issn.0253-3820.100345 |
| [13] |
ARONSON A I, SHAI Y. Why Bacillus thuringiensis insecticidal toxins are so effective:Unique features of their mode of action[J]. FEMS Microbiology Letters, 2001, 195(1): 1-8. DOI:10.1111/fml.2001.195.issue-1 |
| [14] |
ROSAS-GARCÍA N M. Biopesticide production from Bacillus thuringiensis:An environmentally friendly alternative[J]. Recent Patents on Biotechnology, 2009, 3(1): 28-36. DOI:10.2174/187220809787172632 |
| [15] |
HELGASON E, ∅KSTAD O A, CAUGANT D A, et al. Bacillus anthracis, Bacillus cereus, and Bacillus thuringiensis—One species on the basis of genetic evidence[J]. Applied and Environmental Microbiology, 2000, 66(6): 2627-2630. DOI:10.1128/AEM.66.6.2627-2630.2000 |
| [16] |
SETLOW B, LOSHON C A, GENEST P C, et al. Mechanisms of killing spores of Bacillus subtilis by acid, alkali and ethanol[J]. Journal of Applied Microbiology, 2002, 92(2): 362-375. DOI:10.1046/j.1365-2672.2002.01540.x |
| [17] |
XIE C A, LI Y Q. Confocal micro-Raman spectroscopy of single biological cells using optical trapping and shifted excitation difference techniques[J]. Journal of Applied Physics, 2003, 93(5): 2982-2986. DOI:10.1063/1.1542654 |
| [18] |
XIE C A, LI Y Q, TANG W, et al. Study of dynamical process of heat denaturation in optically trapped single microorganisms by near-infrared Raman spectroscopy[J]. Journal of Applied Physics, 2003, 94(9): 6138-6142. DOI:10.1063/1.1617359 |
| [19] |
PUPPELS G J, DE MUL F F, OTTO C, et al. Studying single living cells and chromosomes by confocal Raman microspectroscopy[J]. Nature, 1990, 347(6290): 301-303. DOI:10.1038/347301a0 |
| [20] |
TALARI A C S, MOVASAGHI Z, REHMAN S, et al. Raman spectroscopy of biological tissues[J]. Applied Spectroscopy Reviews, 2015, 50(1): 46-111. DOI:10.1080/05704928.2014.923902 |
| [21] |
WANG G W, ZHANG P F, SETLOW P, et al. Kinetics of germination of wet-heat-treated individual spores of Bacillus species, monitored by Raman spectroscopy and differential interference contrast microscopy[J]. Applied and Environmental Microbiology, 2011, 77(10): 3368-3379. DOI:10.1128/AEM.00046-11 |
| [22] |
ZHANG P F, GARNER W, YI X, et al. Factors affecting variability in time between addition of nutrient germinants and rapid dipicolinic acid release during germination of spores of Bacillus species[J]. Journal of Bacteriology, 2010, 192(14): 3608-3619. DOI:10.1128/JB.00345-10 |
| [23] |
WANG G W, YI X, LI Y Q, et al. Germination of individual Bacillus subtilis spores with alterations in the GerD and SpoVA proteins, which are important in spore germination[J]. Journal of Bacteriology, 2011, 193(9): 2301-2311. DOI:10.1128/JB.00122-11 |
| [24] |
SETLOW B, COWAN A E, SETLOW P. Germination of spores of Bacillus subtilis with dodecylamine[J]. Journal of Applied Microbiology, 2003, 95(3): 637-648. DOI:10.1046/j.1365-2672.2003.02015.x |
| [25] |
VEPACHEDU V R, SETLOW P. Role of SpoVA proteins in release of dipicolinic acid during germination of Bacillus subtilis spores triggered by dodecylamine or lysozyme[J]. Journal of Bacteriology, 2007, 189(5): 1565-1572. DOI:10.1128/JB.01613-06 |
| [26] |
SETLOW B, ATLURI S, KITCHEL R, et al. Role of dipicolinic acid in resistance and stability of spores of Bacillus subtilis with or without DNA-protective α/β-type small acid-soluble proteins[J]. Journal of Bacteriology, 2006, 188(11): 3740-3747. DOI:10.1128/JB.00212-06 |
 2017, Vol. 24
2017, Vol. 24 


