2. 亚热带农业生物资源保护与利用国家重点实验室, 广西南宁 530005
2. State Key Laboratory for Conservation and Utilization of Subtropical Agro-biore-sources, Nanning, Guangxi, 530005, China
【研究意义】嗜盐淀粉酶在许多行业中都具有潜在的应用价值,如医药、纺织、制糖、酿造、食品及洗涤行业[1-4]。了解嗜盐α-淀粉酶的嗜盐机制,不仅对解决蛋白质的折叠、稳定性的保持、溶解性的提高有重要意义,而且能为生物技术应用工程稳定蛋白质或酶提供指导方针和范本。【前人研究进展】目前有一些文献指出,蛋白质表面富含负电荷氨基酸残基是这类来自于嗜盐微生物蛋白质的最突出特征之一[5-7]。为研究嗜盐淀粉酶的嗜盐机理,Zorgani等[8]对大量的嗜盐及非嗜盐淀粉酶的氨基酸组成进行了序列比对,并着重研究嗜盐酶的结构特征。与非嗜盐酶相比,嗜盐酶呈现出不一样的三维结构以保证其在高盐浓度的环境下能维持稳定性和活力[8]。【本研究切入点】为了解嗜盐α-淀粉酶的嗜盐性与氨基酸序列及离子结合位点的关系,采用定点突变技术对RSA离子结合位点上的氨基酸进行改造研究。【拟解决的关键问题】通过改变嗜盐α-淀粉酶的蛋白质序列来研究是否离子结合位点本身的变化影响了酶与盐之间的相互作用,从而表现出不同的稳定性与嗜盐性。
1 材料与方法 1.1 材料 1.1.1 样本的采集根据田菁的植物特征,从广西南宁市石埠码头靠河流附近采集到一株田菁,取其根部及根瘤周围土壤。
1.1.2 主要试剂由Beyotime公司生产的小剂量质粒提取试剂盒 (Biospin Plasmid DNA Extraction Kit)、PCR产物纯化试剂盒 (PCR Purification Kit) 以及DNA凝胶回收试剂盒 (DNA Gel Extraction Kit)。IPTG、SDS为CALBIOCHEM公司产品。Yeast extract、Tryptone为OXIOD公司产品。dNTP、TEMED、Tris碱、N,N’-甲叉双丙烯酰、NaCl、丙烯酰胺、苯酚、RNase A、四水亚硫酸钠、溴酚蓝、磷酸二氢钠、磷酸氢二钠等均为上海生工生产。
1.1.3 菌种和质粒Escherichia coli JM109、表达载体pSE380(色氨酸启动子、复制子PBR322、Amp抗性) 均为本实验组保藏菌种。
1.2 方法 1.2.1 引物设计通过PCR从田菁根瘤菌根瘤及根瘤周围土壤的宏基因组中克隆到一个注释为α-淀粉酶的ORF rsa,测序结果表明这个ORF来自于Rhizobium sp.IRBG74。利用NCBI网站上BLAST对获得的α-淀粉酶的氨基酸进行序列比对,得到相似性最高的氨基酸信息,找到其中相对应的核苷酸序列进行引物设计。设计的引物序列如下:
P1:5′-CCGGAATTCATGCATCATCATCATCATCATATGGCCGGACGCACCTTGCTT-3′,
P2:5′-CCCAAGCTTTCACCCGGATTCGGC-TGGCAC-3′。
1.2.2 PCR扩增目的片段以田菁根瘤周围土壤菌种中获得的宏基因组DNA为模板,设计的P1、P2为引物进行PCR扩增。PCR反应体系25 μL,扩增条件:94℃预变性2 min;94℃变性30 s,45℃退火45 s,72℃延伸2 min,循环29次;最后72℃延伸10 min。
1.2.3 重组表达载体的构建及目的蛋白的纯化利用限制性内切酶EcoR Ⅰ及Hind Ⅲ对胶回收获得的PCR产物和表达载体pSE380分别进行双酶切处理后,利用热激法转入大肠杆菌JM109中并进行测序验证。挑测序正确的重组菌接种于LB培养基 (Amp浓度为100 μg/mL) 中,于37℃、220 r/min摇床中恒温培养。待OD600值达到0.6时加入终浓度为0.6 mmol/L的IPTG,于30℃、220 r/min摇床中诱导表达6 h。最后,收集菌体用裂解缓冲液 (10 mmol/L咪唑,50 mmol/L NaH2PO4) 充分重悬菌体后进行超声波破胞。对破胞液进行离心取上清,用镍柱亲和层析纯化蛋白,采用SDS-PAGE检测纯化蛋白的分子量大小和纯度。
1.2.4 突变位点的选择本课题组已研究的来自大肠杆菌的K6 α-淀粉酶的突变子中,K6-N204D的嗜盐性相较原始的K6得到提高。RSA与K6的氨基酸序列同源性较高,该位点对应到RSA为D205位点,而且经过预测分析,这两个位点在各自蛋白质三维空间结构上的位置都处于离子结合位点上,这个位点的氨基酸可能与离子直接接触,所以选择该位点进行突变研究。
1.2.5 重组酶和突变酶酶活的测定酶活力测定的方法参考3,5-二硝基水杨酸比色法 (Bernfeld法)[9]对还原糖的含量进行测定,并结合之前测定的葡萄糖标准曲线对测定结果进行计算。将190 μL、含有1%(W/V) 的可溶性淀粉为底物的反应缓冲液加入至1.5 mL的Ep管中,使用移液枪每隔10 s加入10 μL的稀释一定倍数的纯酶液。将10 μL经煮沸灭活的纯酶加入到相同的缓冲液中作为空白对照组。在最适条件下反应10 min后,各管加入400 μL DNS终止反应,移至沸水浴中加热5 min显色;然后各取200 μL混合液加至96孔板中,测定混合液的吸光值OD540,再结合葡萄糖标准曲线计算出葡萄糖的产量。α-淀粉酶的酶活力单位定义:处于最适条件时,每分钟生成1 μmol葡萄糖所需的酶量为一个酶活力单位 (U)。α-淀粉酶活力的计算:α-淀粉酶活力单位 (U/mL)=(葡萄糖含量×103×稀释倍数)/(198.17×10×0.01),比活力=最高酶活力 (U)/纯化后蛋白质的含量 (mg)。
1.2.6 重组酶和突变酶酶学性质的测定(1) pH值对酶活力的影响
使用不同pH值的磷酸-柠檬酸缓冲液与可溶性淀粉进行底物的配制,取10 μL稀释的纯酶液与190 μL底物在37℃恒温水浴锅中反应10 min。根据公式计算酶活力,以最高相对酶活力为100%,绘制pH值对酶活力的影响曲线。
(2) 温度对酶活力的影响
使用最适pH值的磷酸-柠檬酸缓冲液与可溶性淀粉进行底物的配制,取10 μL稀释的纯酶液与190 μL底物分别在不同温度下反应10 min。根据公式计算酶活力,以最高相对酶活力为100%,绘制温度对酶活力的影响曲线。
(3) 最适NaCl浓度
使用最适pH值的磷酸-柠檬酸缓冲液与可溶性淀粉进行底物的配制,并加入不同浓度的NaCl溶液。取10 μL稀释的纯酶液与190 μL含不同浓度NaCl的底物在最适温度下反应10 min。根据公式计算酶活力,以最高相对酶活力为100%,绘制pH值对酶活力的影响曲线。
(4) Ca2+对酶活力的影响
使用最适pH值的磷酸-柠檬酸缓冲液稀释酶液,使稀释后的酶液中含有不同终浓度的Ca2+。将稀释后的酶液于4℃处理12 h。取10 μL经处理的酶液与190 μL底物在最适温度下反应10 min。以最高相对酶活力为100%,绘制不同浓度的Ca2+对酶活力影响曲线。
(5) EDTA对酶活力的影响
使用最适pH值的磷酸-柠檬酸缓冲液稀释酶液,使稀释后的酶液中含有不同终浓度的EDTA。将稀释后的酶液于4℃处理12 h。取10 μL经处理的酶液与190 μL底物在最适温度下反应10 min (未经处理的酶液为空白对照)。以空白对照的相对酶活力为100%,绘制不同浓度的EDTA对酶活力影响曲线。
(6) 金属离子对酶活力的影响
使用最适pH值的磷酸-柠檬酸缓冲液与可溶性淀粉进行底物配置,使得底物中的NiCl2、MgCl2、CuCl2、FeCl3、CoCl2、CaCl2、ZnSO4、PbAc、MnCl2、BaCl2的终浓度为10 mmol/L。取10 μL稀释的纯酶液与190 μL含不同金属的底物在最适温度下反应10 min (无金属离子的底物为空白对照)。根据公式计算酶活力,以空白对照的相对酶活为100%,绘制不同盐溶液对酶活性影响的柱状图。
2 结果与分析 2.1 重组酶的表达与纯化如图 1所示,利用SDS-PAGE凝胶电泳对获得的重组蛋白RSA进行纯化,重组酶的蛋白质大小为55 kDa。结果表明RSA在大肠杆菌JM109中成功表达,且经过IPTG诱导表达所产生的目的蛋白条带较为单一,可以进行下一步研究。
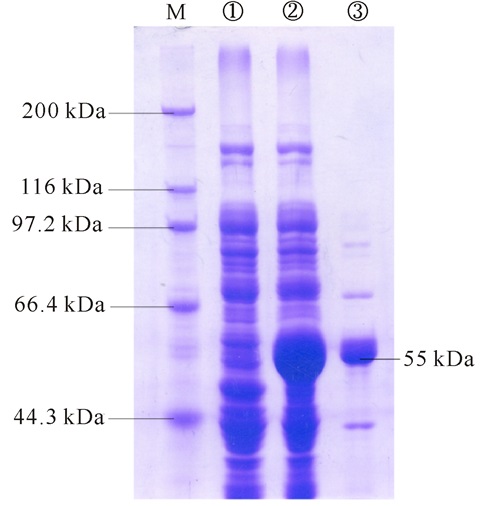
|
M:蛋白质Marker;① 诱导空载体pSE380/JM109可溶性蛋白;② 诱导转化子可溶性蛋白质;③ 纯化目的蛋白RSA M:Protein marker; ① Proteins from soluble fractions of pSE380/JM109 with induction; ② Proteins from soluble fractions of pSE380-RSA/JM109 with induction; ③ Purified RSA from soluble fractions of pSE380-RSA/JM109 图 1 重组蛋白RSA的SDS-PAGE凝胶电泳 Fig.1 SDS-PAGE gel of RSA purification steps |
如图 2所示,RSA的最适pH值为7.5,在pH值7.0以下及pH值8以上的溶液中RSA的酶活下降很明显,当pH值下降到6时RSA基本失去酶活力,表明RSA的pH耐受范围较小。
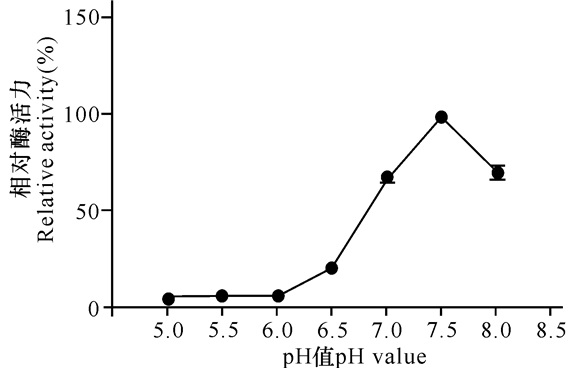
|
图 2 RSA的最适pH值 Fig.2 Optimal pH value of RSA |
如图 3所示,RSA的最适温度是45℃,在35~50℃时酶的活性较高,相对活力维持在60%以上。温度超过50℃后的酶活力有较大的降低,表明RSA不能耐高温,低温下稳定性较好。
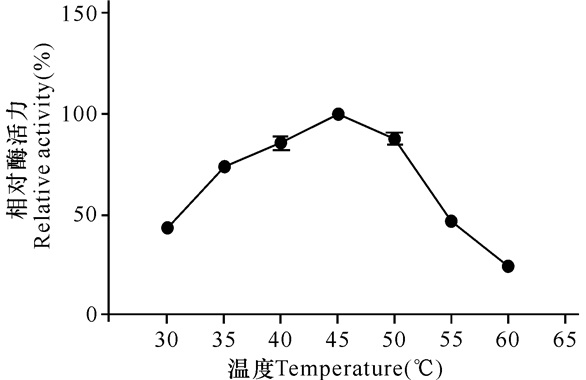
|
图 3 RSA的最适温度 Fig.3 Optimal temperature of RSA |
由图 4可见,RSA的最适NaCl浓度为5 mol/L,在2~5 mol/L NaCl环境中酶活力不断升高,到6 mol/L时开始下降。说明RSA的嗜盐性较高,属于极端嗜盐酶。
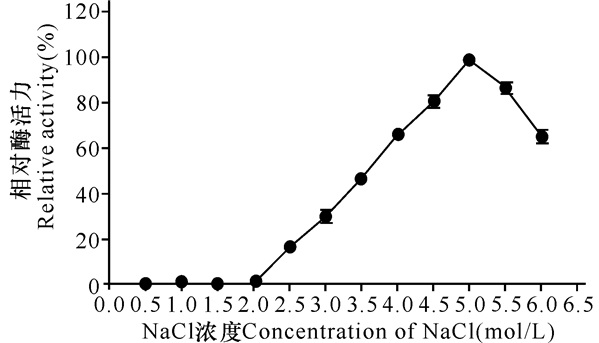
|
图 4 RSA的最适NaCl浓度 Fig.4 Optimal NaCl of RSA |
如图 5所示,在0~5 mmol/L Ca2+溶液中,随着Ca2+浓度增加,酶活力不断地升高,说明Ca2+对RSA具有激活作用。在Ca2+达到5 mmol/L以上时出现酶活抑制现象,说明Ca2+浓度在5 mmol/L的时候激活作用最强。
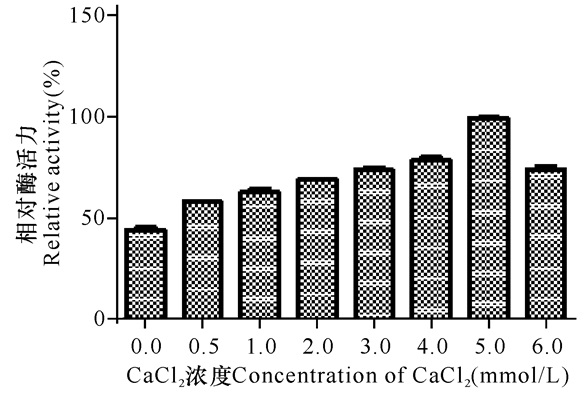
|
图 5 Ca2+对重组酶活性的影响 Fig.5 Effect of Ca2+ on recombinant enzyme activity |
如图 6所示,从实验结果可知EDTA对重组酶RSA的酶活性影响很大,相对酶活力均在10%以下,说明重组酶RSA是一种金属酶。
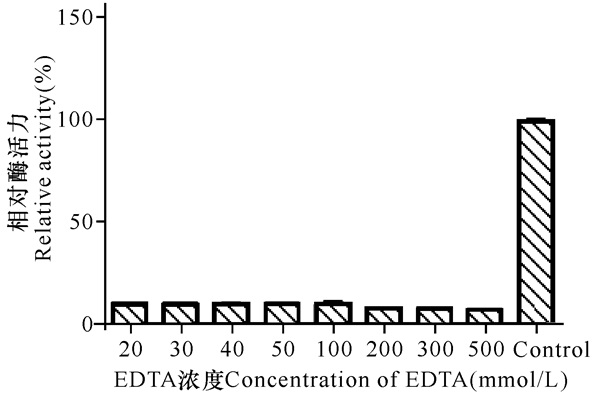
|
图 6 EDTA对重组酶活性的影响 Fig.6 Effect of EDTA on recombinant enzyme activity |
如图 7所示,Cu2+、Fe3+、Zn2+、Pb2+均对RSA有抑制作用,其中Zn2+对于RSA的抑制作用不明显。Ni2+、Mg2+、Co2+、Ca2+、Mn2+、Ba2+均对RSA有激活作用,其中Co2+、Ca2+对RSA的激活效果显著,而Ba2+对于RSA的激活效果不明显。
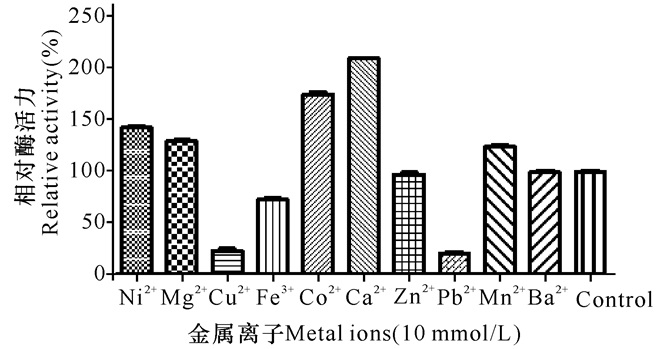
|
图 7 金属离子对RSA活力的影响 Fig.7 Effect of metal ions on RSA activity |
在17个突变子中 (表 1),RSA的D205K、D205I、D205M、D205L、D205S、D205N、D205T、D205F、D205H、D205E突变子为嗜盐酶,但是嗜盐性较RSA均有所下降。另外,RSA-D205R、RSA-D205C突变子的最适温度均为80℃,相比野生重组酶上升35℃成为嗜热酶。
| 表 1 定点突变子的酶学性质汇总 Table 1 Summarize the enzyme proporties of site-saturation mutants |
通过分析PDB数据库中一些酶的三维结构后发现, 大多数氨基酸是用来维持酶分子结构上的稳定,少部分氨基酸作为构成活性中心的关键氨基酸,这些关键氨基酸对酶分子的催化活性影响巨大,对这类型氨基酸进行替换可能会引起酶学性质的改善。RSA最适NaCl浓度为5 mol/L, 为极端嗜盐酶。本实验通过对RSA-D205位点进行突变,突变子的嗜盐性均有所降低。另外,RSA-D205R、RSA-D205C这两个突变子的最适反应温度达到80℃,相较原始的RSA提高35℃。精氨酸 (R)、半胱氨酸 (C) 也许对淀粉酶的高温改造具有参考价值。这些改变可能是因为离子结合位点本身的变化影响酶与盐之间的相互作用,从而表现出不同的性能。同时RSA嗜盐淀粉酶是从非嗜盐菌田菁根瘤菌中获得的,打破了嗜盐酶从嗜盐菌中获得的传统。由于RSA的晶体结构尚未被完全理解,突变位点的选择存在较大的不可预见性和盲目性。仅从这些定点突变结果还不能完全说明该离子结合位点是如何影响酶的性能,但是这些结果可以为嗜盐淀粉酶的分子改造积累经验。目前嗜盐酶在生物技术应用方面的潜力还没有被广泛地开发利用[10],但是相比在极端环境下比如高温、宽范围的pH值或者在物理化学都不适合的普通酶[11]来说,这些属性使得嗜盐水解酶在工业生产上得到更广泛的应用。
| [1] |
RASIAH I A, REHM B H A. One-step production of immobilized α-amylase in recombinant Escherichia coli[J]. Applied & Environmental Microbiology, 2009, 75(7): 2012-2016. |
| [2] |
GHOLLASI M, KHAJEH K, NADERI-MANESH H, et al. Engineering of a Bacillus α-amylase with the improved rmostability and calcium independency[J]. Applied Biochemistry & Biotechnology, 2010, 162(2): 444-459. |
| [3] |
DELGADO-GARCÍA M, VALDIVIA-URDIALES B, AGUILAR-GONZÁLEZ C N, et al. Halophilic hydrolases as a new tool for the biotechnological industries[J]. Journal of the Science of Food and Agriculture, 2012, 92(13): 2575-2580. DOI:10.1002/jsfa.v92.13 |
| [4] |
VAN DER MAAREL M J E C, VAN DER VEEN B, UITDEHAAG J C M, et al. Properties and applications of starch-converting enzymes of the α-amylase family[J]. Journal of Biotechnology, 2002, 94(2): 137-155. DOI:10.1016/S0168-1656(01)00407-2 |
| [5] |
MEVARECH M, FROLOW F, GLOSS L M. Halophilic enzymes:Proteins with a grain of salt[J]. Biophysical Chemistry, 2000, 86(2/3): 155-164. |
| [6] |
EISENBERG H. Life in unusual environments:Progress in understanding the structure and function of enzymes from extreme halophilic bacteria[J]. Archives of Biochemistry and Biophysics, 1995, 318(1): 1-5. DOI:10.1006/abbi.1995.1196 |
| [7] |
ELCOCK A H, MCCAMMON J A. Electrostatic contributions to the stability of halophilic proteins[J]. Journal of Molecular Biology, 1998, 280(4): 731-748. DOI:10.1006/jmbi.1998.1904 |
| [8] |
ZORGANI M A, PATRON K, DESVAUX M. New insight in the structural features of haloadaptation in α-amylases from halophilic Archaea following homology modeling strategy:Folded and stable conformation maintained through low hydrophobicity and highly negative charged surface[J]. Journal of Computer-aided Molecular Design, 2014, 28(7): 721-734. DOI:10.1007/s10822-014-9754-y |
| [9] |
DOUGLAS T L, CLONCE A J, JONES G C.3, 5-dinitrosalicylic acid[M].US:1983.
|
| [10] |
GONZÁLEZ-HERNÁNDEZ J C, PEÑA A. Strategies of adaptation of halophilic microorganisms and Debaryomyces hansenii(halophilic yeast)[J]. Revista Latinoamericana de Microbiologia, 2002, 44(3/4): 137-156. |
| [11] |
COJOC R, NEAGU S, POPESCU G T, et al. Extracellular hydrolytic enzymes of halophilic bacteria isolated from a subterranean rock salt crystal[J]. Romanian Biotechnological Letters, 2009, 14(5): 4658-4664. |
 2017, Vol. 24
2017, Vol. 24 


