2. 广西大学,生命科学与技术学院,广西南宁 530004
2. College of Life Science and Technology, Guangxi University, Nanning, Guangxi, 530004, China
【研究意义】 随着煤、石油、天然气等化石燃料日益枯竭,人类寻找可替代能源或者开发可再生能源迫在眉睫。生物质能源作为一种可再生能源,具有原料来源广泛、价格低廉、低碳环保、绿色清洁可循环使用等一系列的优势[1],已成为当前世界各国研究的热点。其原料来源之一——木质纤维素类物质,是世界上最为丰富的可再生资源,其主要由纤维素、半纤维素和木质素组成[2]。木聚糖是半纤维素重要组成部分,其含量仅次于纤维素,是自然界中第二大丰富的多聚糖,占20%~30%[3]。木聚糖是高聚物,分子量庞大,须先降解成小分子的木寡糖和木糖才能被有效地利用。降解方法有传统的化学法和生物酶催化水解法。生物酶催化水解法是采用木聚糖酶降解木聚糖,相较于化学法具有明显的优势,表现在更高效的转化速率、无腐蚀性及环保等方面[4]。木聚糖酶是可以将木聚糖降解成低聚木糖和木糖的一组酶的总称,包括β-1, 4-内切酶 (1, 4-β-D-xylan xylanohydrolase,EC 3.2.1.8)、β-木糖苷酶 (β-D-xylosidase, EC 3.2.1.37) 和支链酶如α-L-呋喃阿拉伯糖苷酶 (EC 3.2.1.55) 等[5],而降解木聚糖最关键的是β-1, 4-内切酶和β-木糖苷酶[6]。通常所说的木聚糖酶是指β-1, 4-内切酶,它以内切方式水解木聚糖分子中的β-1, 4-木糖苷键,其水解产物主要是木二糖和木寡糖。【前人研究进展】国外对木聚糖酶的研究比较早,早在1955年SØrensen[7]就发现存在于土壤和牛瘤胃中的木聚糖酶。目前,产木聚糖酶的菌株有黑曲霉Aspergillus niger[8-10]、里氏木霉Trichoderma reesei[11]、链霉菌Streptomyces sp. Ab106[12]、高温放线菌Thermoactinomyces thalophilus subgroup C[13]、节图霉属Arthrographis sp.[14]、微紫青霉菌Penicillium janthinellum[15]等。木聚糖酶广泛应用于工业、食品、养殖、造纸、生物医学等方面[3, 16-18],自然界中微生物来源的木聚糖酶绝大多数属于碱性木聚糖酶,国内外对碱性木聚糖酶早已实现商业化生产;而国内较早进行酸性木聚糖研究的是1990年山东大学微生物研究所的陈惠忠等[19],一般集中在产酶微生物选育、酶学性质研究、酶改造等[20]。近年来随着纤维素乙醇日益成为研究的热点和难点问题[21-22],开发高效的工业酸性木聚糖酶 (常温30~37℃、pH值在4.0左右等酸性条件下仍然保持较高酶活性) 已成为一个重要研究方向,目的是利用酸性木聚糖酶将富含木聚糖的半纤维素组分降解为木糖等产物供酵母 (如树干毕赤酵母) 进行酒精发酵[23],从而为实现纤维素乙醇低成本清洁生产打下基础。【本研究切入点】在已有菌种基础上,对黑曲霉和里氏木霉产酸性木聚糖酶的性能及所产粗酶的酶学特性进行分析比较。【拟解决的关键问题】考察两种菌所产的酸性木聚糖酶在pH值为4时的酶活及稳定性,从而确定潜在的较为理想的酸性木聚糖酶。
1 材料与方法 1.1 材料 1.1.1 试剂榉木木聚糖 (Beechwood xylan)、羧甲基纤维素钠 (CMC-Na) 购自Sigma,桦木木聚糖 (Birchwood xylan) 购自上海瀚鸿化工,对硝基苯基-β-D-木糖苷 (pNPX) 购自上海梯希爱,Bradford蛋白定量试剂盒购自上海捷瑞,其他为国产分析纯试剂。
1.1.2 菌种黑曲霉Aspergillus niger CICC40616,里氏木霉Trichoderma reesei CICC40360。
1.1.3 培养基产酶培养基 (g/L):榉木或桦木木聚糖10,蛋白胨10,(NH4)2SO4 5,KH2PO4 1,MgSO4·7H2O 0.5,FeSO4·7H2O 0.01,CaCl2 0.2,调节pH值至4.0。
菌种活化或保藏培养基 (PDA,g/L):马铃薯200,葡萄糖20,琼脂20,pH值自然。
1.2 方法 1.2.1 产酶情况比较将菌种于PDA培养基中培养活化3次后,接种到不同的产酶培养基中 (分别含有桦木木聚糖和榉木木聚糖) 进行培养,培养7 d,每天取样测酶活和蛋白含量。
1.2.2 酶活力测定方法(1) 木聚糖酶[24]
取发酵液,4℃、4 000 r/min×15 min条件下离心,取上清用0.05 mol/L柠檬酸-磷酸氢二钠缓冲液 (pH值为4.0) 适当稀释成酶液;将1.8 mL 1%(W/V) 木聚糖底物 (50℃水浴预热) 加入0.2 mL酶液混匀后,50℃水浴5 min,然后加入3 mL DNS终止反应,并迅速置于沸水浴显色5 min,冰水冷却,测定OD520。1%(W/V) 木聚糖底物的配制方法如下:用0.05 mol/L柠檬酸-磷酸氢二钠缓冲液 (pH值为4.0) 配置。1个酶活力单位 (IU) 是指在特定反应条件下,在1 min内能转化1 μmol底物的酶量。
(2) 木糖苷酶[25]
取发酵液,4℃、4 000 r/min×15 min条件下离心,取上清即酶液20 μL,然后加入270 μL 0.05 mol/L柠檬酸-磷酸氢二钠缓冲液 (pH值为4.0)、5 μL 20 mmol/L pNPX底物,混匀后于50℃水浴反应10 min,加1.5 mL 1 mol/L NaHCO3终止反应,测定OD400。1个酶活力单位 (IU) 是指在特定反应条件下,在1 min内能转化1 μmol底物的酶量。
(3) 纤维素酶 (CMCase酶活力)
方法同木聚糖酶酶活测定方法,但底物是1%(W/V) 羧甲基纤维素钠,测定OD540,测定酸性 (pH值为4.0) 条件下的CMCase活力。1个酶活力单位 (IU) 是指在特定反应条件下,在1 min内能转化1 μmol底物的酶量。
1.2.3 蛋白含量测定用Bradford蛋白定量试剂盒测定,样品测定的体积均为20 μL,操作按说明书进行。
1.2.4 酶学性质(1) 酶的最适温度及热稳定性
在不同温度 (20~90℃) 下于0.05 mol/L柠檬酸-磷酸氢二钠缓冲液 (pH值为4.0) 中进行酶促反应,测定酶活力从而确定酶的最适温度。
在不同温度下分别保温5~30 min,经冰水冷却后,于0.05 mol/L柠檬酸-磷酸氢二钠缓冲液 (pH值为4.0) 中进行酶促反应,酶促反应温度均为50℃,测定酶活力从而研究酶的热稳定性。
(2) 酶最适pH值及稳定性
酶液经稀释后,在不同pH值条件下于50℃水浴下进行酶促反应以测定最适pH值。所用缓冲液为pH值为2.10~8.50的0.05 mol/L柠檬酸-磷酸氢二钠缓冲液,pH值为9.00~12.00的0.05 mol/L甘氨酸-NaOH缓冲液。
酶液在不同pH值 (2.10~12.00) 条件下4℃处理24 h,经0.05 mol/L柠檬酸-磷酸氢二钠缓冲液 (pH值为4.0) 适当稀释后测定酶活力以研究酶的pH稳定性。
2 结果与分析 2.1 产酶情况比较利用榉木木聚糖和桦木木聚糖为底物时,黑曲霉的酸性木聚糖酶酶活力5 d时均达到最高,分别为 (52.36±2.61) U/mL、(33.59±0.28) U/mL;酸性木糖苷酶酶活力6 d均达到最高,分别为 (0.57±0.01) U/mL、(0.55±0.02) U/mL;蛋白含量均逐渐增多,7 d均达到最高,分别为 (9.32±0.17)μg/20 μL、(8.34±0.06)μg/20 μL,可以看出榉木木聚糖比桦木木聚糖更有利于黑曲霉产酶 (图 1a~c)。而对于里氏木霉来说 (图 1d~f),情况则有所不同:分别以桦木木聚糖和榉木木聚糖为底物时,产酸性木聚糖酶酶活力5 d或4 d达到最高,分别为 (10.12±0.95) U/mL、(1.41±0.16) U/mL;利用桦木木聚糖所产的酸性木糖苷酶酶活力3 d达到最高,为 (0.32±0.05) U/mL,但利用榉木木聚糖所产酶液几乎检测不到酸性木糖苷酶酶活力;蛋白含量均不高,最高分别为 (2.52±0.16)μg/20 μL、(2.11±0.29)μg/20 μL,均低于黑曲霉所产的酶蛋白 (图 1c、f)。由此可知,两种木聚糖作为诱导物,黑曲霉所产的酸性木聚糖酶和酸性木糖苷酶的酶活力均比里氏木霉的高。此外,两个菌株所产的酸性木聚糖酶兼有酸性CMCase酶活力,黑曲霉的为 (5.26±0.21) U/mL,里氏木霉的为 (1.72±0.21) U/mL,前者的酶活力是后者的3倍。综上所述,黑曲霉产酶能力比里氏木霉的强。
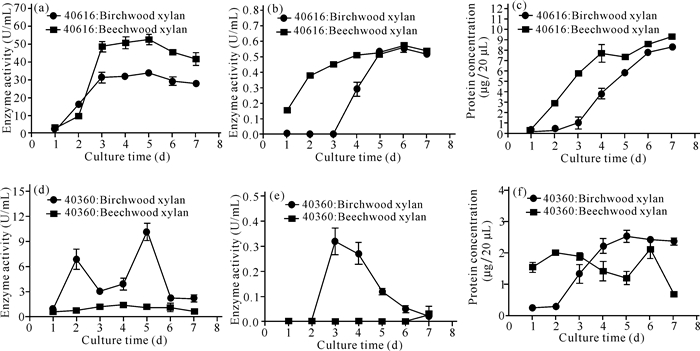
|
(a、d) 木聚糖酶曲线,(b、e) 木糖苷酶曲线,(c、f) 蛋白曲线 (a, d) Curve of xylanase, (b, e) Curve of xylosidase, (c, f) Curve of protein 图 1 黑曲霉40616和里氏木霉40360的产酶曲线 Fig.1 Curve of xylanases of Aspergillus niger and Trichoderma reesei |
选取酶活力最强时的上清液作为原酶液,分别进行最适温度和热稳定性实验 (图 2~3)。黑曲霉和里氏木霉所产的酸性木聚糖酶最适温度分别为55℃和65℃(图 2a、c),前者的热稳定性比后者的差,前者在高于最适温度5℃(即60℃) 条件下保温5 min或10 min,酶活力分别下降近40%和60%;后者在高于最适温度5℃(即70℃) 条件下保温30 min,酶活力仅下降不到30%(图 2b、d)。值得一提的是黑曲霉的酸性木聚糖酶在30~40℃条件下,酶活力能达到最适温度的60%以上,这对于常温开发利用黑曲霉木聚糖酶非常有利。黑曲霉和里氏木霉所产的酸性木糖苷酶最适温度分别为75℃和65℃(图 3a、c),两者在高于最适温度5℃(即80℃或70℃) 条件下保温5 min,检测到的酶活力很低 (图 3b、d),说明两者的热稳定性均比较差。此外,在30~40℃条件下,两者的酸性木糖苷酶酶活力不到最适温度的30%。
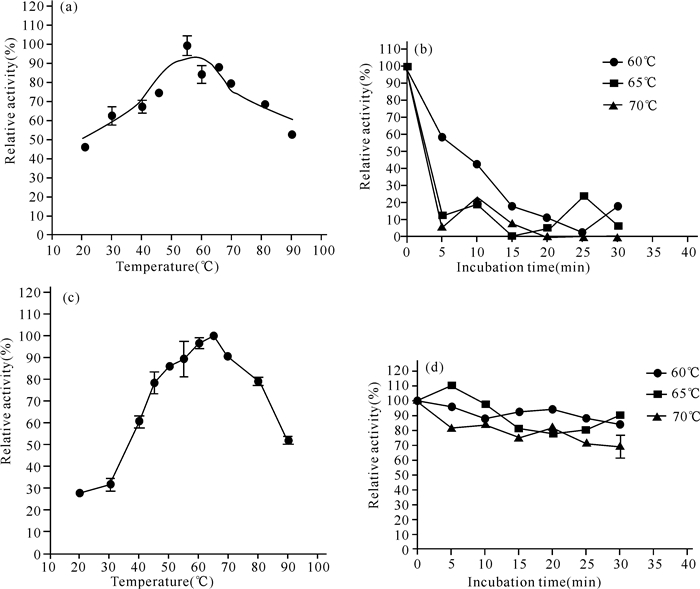
|
(a、b) 黑曲霉,(c、d) 里氏木霉,(a、c) 最适温度,(b、d) 热稳定性 (a, b)Aspergillus niger, (c, d)Trichoderma reesei, (a, c) Optimum temperature, (b, d) Thermal stability 图 2 酸性木聚糖酶的最适温度及热稳定性 Fig.2 Optimum temperature and thermal stability of acidic xylanase |
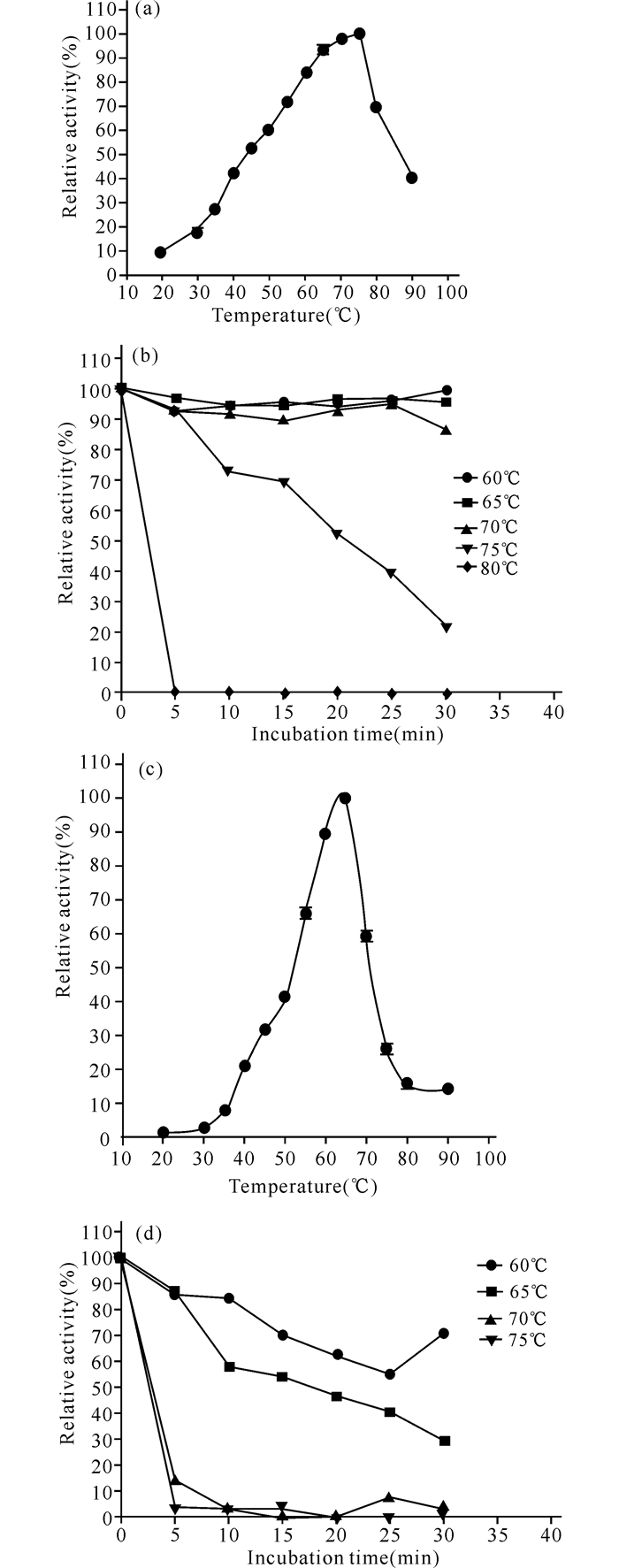
|
(a、b) 黑曲霉,(c、d) 里氏木霉,(a、c) 最适温度,(b、d) 热稳定性 (a, b) Aspergillus niger, (c, d)Trichoderma reesei, (a, c) Optimum temperature, (b, d) Thermal stability 图 3 酸性木糖苷酶的最适温度及热稳定性 Fig.3 Optimum temperature and thermal stability of acidic xylosidase |
黑曲霉和里氏木霉所产的酸性木聚糖酶最适pH值分别为5.0和6.5(图 4a、b),前者在酸性条件下 (3.0~5.0) 稳定性比后者的略好,但在中性和碱性条件下后者的稳定性比前者略好;两者在pH值为4.0条件下,酶活力仍能保持最适pH值条件下30%的活性。黑曲霉和里氏木霉所产的酸性木糖苷酶最适pH值分别为5.0和4.5(图 5a、b),两者在酸性条件下 (2.1~6.0) 稳定性较好,在pH值为2.1条件下酶活力均能达到40%以上,黑曲霉的酸性木糖苷酶更是较为明显达到50%以上;但两者在中性和碱性条件下酶活力很低,尤其是当pH值达到8.0以上,几乎检测不到酶活力。由此可知,黑曲霉和里氏木霉所产的酸性木糖苷酶均比自身所产的酸性木聚糖酶更能耐受酸性条件。
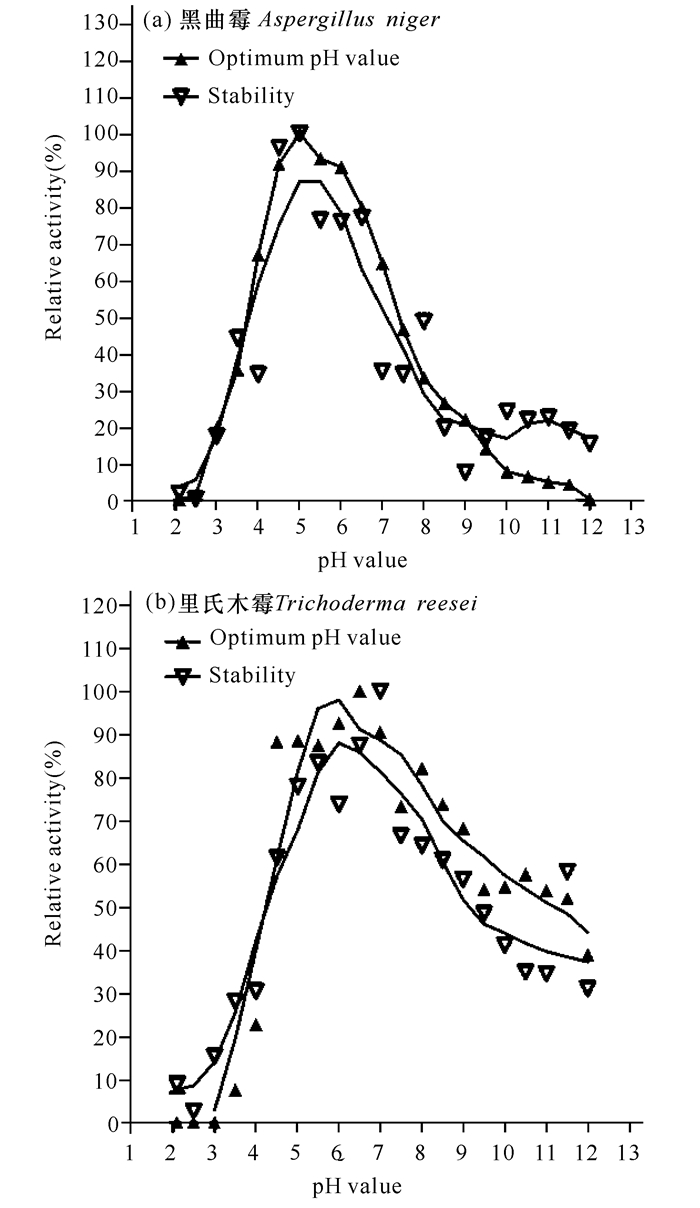
|
图 4 酸性木聚糖酶的最适pH值及pH稳定性 Fig.4 Optimum pH value and stability of acidic xylanase |
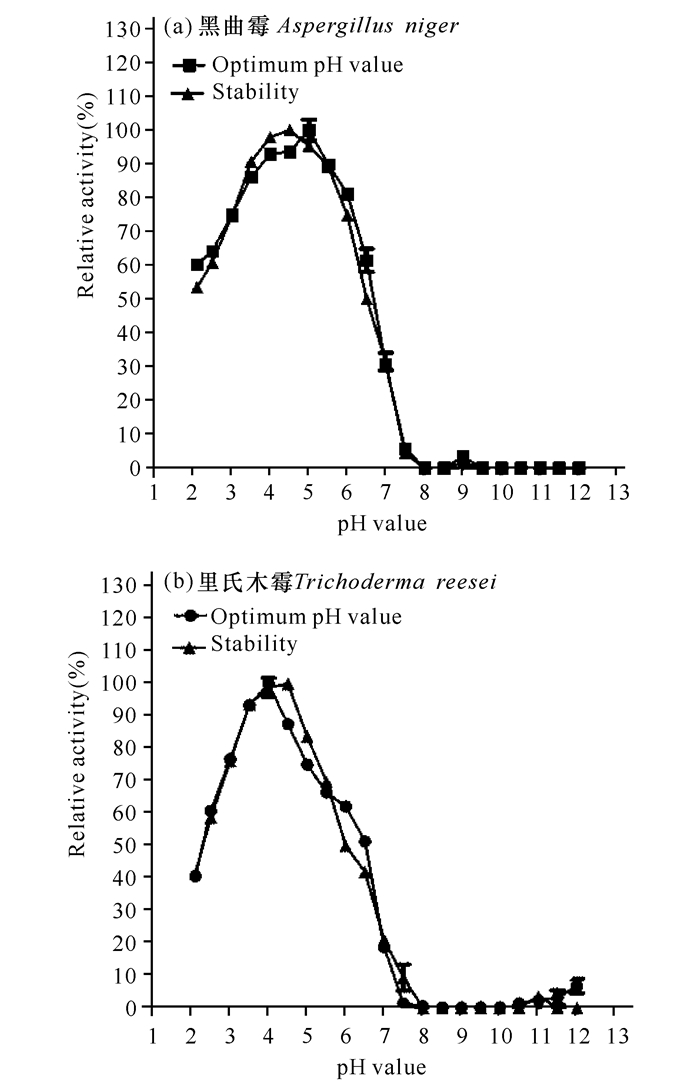
|
图 5 酸性木糖苷酶的最适pH值及pH稳定性 Fig.5 Optimum pH value and stability of acidic xylosidase |
微生物来源的木聚糖酶很多,少部分是来自细菌的,如高温放线菌Thermoactinomyces thalophilussubgroup C[13]、链霉菌Streptomyces sp. Ab106[12]、莫海威芽孢杆菌Bacillus mojavensis[26]等,但大部分是来自真菌的,如黑曲霉Aspergillus niger[8-10]、里氏木霉Trichoderma reesei[11]、微紫青霉菌Penicillium janthinellum[15]等。本研究基于已有菌种的基础上,对黑曲霉和里氏木霉产酸性木聚糖酶的性能进行比较分析,从结果可知,黑曲霉的酸性木聚糖酶酶活力明显优于里氏木霉的,但黑曲霉酸性木聚糖酶酶活力不高,明显达不到工业化要求。陈惠忠等[19]从土壤选育出黑曲霉C-2菌株,该菌株发酵2%(W/V) 半纤维素4 d,木聚糖酶和木糖苷酶活力分别为112.3 U/mL和2.3 U/mL,而通过紫外线和甲基磺酸乙酯诱变C-2菌株获得一突变株An-76,该突变菌株木聚糖酶和木糖苷酶的活力分别为353.6 U/mL和4.5 U/mL,活力分别提高2倍和1倍。陈红歌等[27]选育的产酸性木聚糖酶微生物为黑曲霉Aspergillus niger149菌株,利用麸皮半纤维素 (4%,W/V),28~30℃培养60 h,酶活力最高可达375.2 U/mL。王金华[28]将Aspergillus niger N402的酸性木聚糖酶基因实现在Pichia pastoris表达,重组菌的酶活达到453.6 U/mL,是原始出发菌株N402(40.2 U/mL) 的11.3倍。为此,我们需要借鉴别人成功的经验,对已有菌种进行改造或者从自然界选育产酶微生物,从而构建出性能更优良的酸性木聚糖酶。
3.2 酶学性质木聚糖酶能将木聚糖降解成木寡糖和木二糖,也有少量木糖和阿拉伯糖。木聚糖酶发挥作用受到外界条件的影响,如温度、pH值等。Frederick等[29]报道的黑曲霉木聚糖酶最适温度为45℃,显然比本研究的黑曲霉CICC40616的低10℃,而前者的最适pH值为5.5,跟CICC40616的差不多。Tenkanen等[30]报道的里氏木霉木聚糖酶最适温度为45/40℃,明显比本研究的里氏木霉CICC40360的低20℃左右,且前者的最适pH值 (5.5) 也比后者的低一些,并在pH值3~8.5条件下稳定。
4 结论对黑曲霉和里氏木霉产酸性木聚糖酶的性能及所产粗酶的酶学特性进行分析比较,尤其是考察pH值为4的条件下木聚糖酶酶活力及稳定性,结果发现黑曲霉利用榉木木聚糖比桦木木聚糖更有利于产酶,而对于里氏木霉,则相反,即利用桦木木聚糖比榉木木聚糖更有利于产酶。此外,利用榉木木聚糖,黑曲霉所产的酶蛋白含量明显高于里氏木霉的,而利用桦木木聚糖,黑曲霉和里氏木霉所产的酶蛋白含量相差不大。黑曲霉所产酸性木聚糖酶兼有酸性CMCase酶活力,均优于里氏木霉的,这些对于有效降解木聚糖是非常有利的,是潜在的较为理想的酸性木聚糖酶,可以考虑将其作为改造对象进行改良。但黑曲霉的酸性木聚糖酶酶活力显然达不到工业化要求,亟待我们改造或者从自然界选育产酸性木聚糖酶性能更优良的微生物。
| [1] |
FARGIONE J, HILL J, TILMAN D, et al. Land clearing and the biofuel carbon debt[J]. Science, 2008, 319(5867): 1235-1238. DOI:10.1126/science.1152747 |
| [2] |
BIELY P.Enzymological aspects of the production of microbial hemicellulases[M]//COUGHLAN M P, HAZLEWOOD G P (eds.).Hemicelluloses and hemicellulases.London:Portland Press, 1993: 29-51.
|
| [3] |
PRADE R A. Xylanases:From biology to biotechnology[J]. Biotechnology and Genetic Engineering Reviews, 1995, 13(1): 101-132. |
| [4] |
BISARIA V S, GHOSE T K. Biodegradation of cellulosic materials:Substrates, microorganisms, enzymes and products[J]. Enzyme and Microbial Technology, 1981, 3(2): 90-104. DOI:10.1016/0141-0229(81)90066-1 |
| [5] |
BIELY P. Microbial xylanolytic systems[J]. Trends in Biotechnology, 1985, 3(11): 286-290. DOI:10.1016/0167-7799(85)90004-6 |
| [6] |
SUBRAMANIYAN S, PREMA P. Biotechnology of microbial xylanases:Enzymology, molecular biology, and application[J]. Critical Reviews in Biotechnology, 2002, 22(1): 33-64. DOI:10.1080/07388550290789450 |
| [7] |
SØRENSEN H. Xylanase in the soil and the rumen[J]. Nature, 1955, 176(4471): 74. |
| [8] |
JOHN M, SCHMIDT B, SCHMIDT J. Purification and some properties of five endo-1, 4-β-D-xylanases and β-D-xylosidase produced by a strain of Aspergillus niger[J]. Canadian Journal of Biochemistry, 1979, 57(2): 125-134. DOI:10.1139/o79-016 |
| [9] |
PEL H J, DE WINDE J H, ARCHER D B, et al. Genome sequencing and analysis of the versatile cell factory Aspergillus niger CBS 513.88[J]. Nature Biotechnology, 2007, 25(2): 221-231. DOI:10.1038/nbt1282 |
| [10] |
邢亚梅, 陈勇, 应汉杰. 黑曲霉 (Aspergillus niger) 发酵生产木聚糖酶的pH调控策略[J]. 生物加工过程, 2015, 13(1): 23-27. XING Y M, CHEN Y, YING H J. Two-stage PH control strategy for xylanase production by Aspergillus niger D08[J]. Chinese Journal of Bioprecess Engineering, 2015, 13(1): 23-27. |
| [11] |
TÖRRÖNEN A, MACH R L, MESSNER R, et al. The two major xylanases from Trichoderma reesei:Characterization of both enzymes and genes[J]. Nature Biotechnology, 1992, 10(11): 1461-1465. DOI:10.1038/nbt1192-1461 |
| [12] |
TECHAPUN C, POOSARAN N, WATANABE M, et al. Optimization of aeration and agitation rates to improve cellulase-free xylanase production by Thermotolerant streptomyces sp.Ab106 and repeated fed-batch cultivation using agricultural waste[J]. Journal of Bioscience and Bioengineering, 2003, 95(3): 298-301. DOI:10.1016/S1389-1723(03)80033-6 |
| [13] |
KOHLI U, NIGAM P, SINGH D, et al. Thermostable, alkalophilic and cellulase free xylanase production by Thermoactinomyces thalophilus subgroup C[J]. Enzyme and Microbial Technology, 2001, 28(7/8): 606-610. |
| [14] |
OKEKE B C, OBI S K C. Preliminary studies on a xylanase from an Arthrographisspecies[J]. FEMS Microbiology Letters, 1992, 96(1): 43-47. DOI:10.1111/fml.1992.96.issue-1 |
| [15] |
MILAGRES A M F, LACIS L S, PRADE R A. Characterization of xylanase production by a local isolate of Penicillium janthinellum[J]. Enzyme and Microbial Technology, 1993, 15(3): 248-253. DOI:10.1016/0141-0229(93)90145-R |
| [16] |
VⅡKARI L, KANTELINEN A, SUNDQUIST J, et al. Xylanases in bleaching:From an idea to the industry[J]. FEMS Microbiology Reviews, 1994, 13(2/3): 335-350. |
| [17] |
GOSWAMI G K, PATHAK R R. Microbial xylanases and their biomedical applications:A review[J]. International Journal of Basic & Clinical Pharmacology, 2013, 2(3): 237-246. |
| [18] |
曲音波, 高培基, 陈嘉川. 制浆造纸用木聚糖酶的研究进展[J]. 生物工程进展, 1998, 18(6): 36-40. QU Y B, GAO P J, CHEN J C. Production and application of xylanase preparations for pulp and paper industry[J]. Addvace in Bioegineering, 1998, 18(6): 36-40. |
| [19] |
陈慧忠, 高培基, 王祖农. 产木聚糖酶菌株的选育及其液体发酵条件[J]. 微生物学报, 1990, 30(5): 351-357. CHEN H Z, GAO P J, WANG Z N. Screening of high yield xylanase producing strain and studies on its submerged fermentation conditions[J]. Acta Microbiologica Sinica, 1990, 30(5): 351-357. |
| [20] |
曹钰, 陆健, 李胤. 酸性木聚糖酶的研究进展[J]. 工业微生物, 2005, 35(4): 41-44, 50. CAO Y, LU J, LI Y. Research advances in acid-stable xylanase[J]. Industrial Microbiology, 2005, 35(4): 41-44, 50. |
| [21] |
PERALTA-YAHYA P P, ZHANG F Z, DEL CARD-AYRE S B, et al. Microbial engineering for the production of advanced biofuels[J]. Nature, 2012, 488(7411): 320-328. DOI:10.1038/nature11478 |
| [22] |
THOMAS L, PARAMESWARAN B, PANDEY A. .Hydrolysis of pretreated rice straw by an enzyme cocktail comprising acidic xylanase from Aspergillus sp.for bioethanol production[J]. Renewable Energy, 2016, 98: 9-15. DOI:10.1016/j.renene.2016.05.011 |
| [23] |
吴仁智, 陈东, 芦志龙, 等. 发酵木糖高产乙醇树干毕赤酵母菌株的Co60诱变选育[J]. 广西科学, 2014, 21(1): 47-53. WU R Z, CHEN D, LU Z L, et al. Breeding of high-yield Pichia stipitis strains by Co60 Mutagenesis for ethanol fermentation from xylose[J]. Guangxi Sciences, 2014, 21(1): 47-53. |
| [24] |
BAILEY M J, BIELY P, POUTANEN K. Interlaboratory testing of methods for assay of xylanase activity[J]. Journal of Biotechnology, 1992, 23(3): 257-270. DOI:10.1016/0168-1656(92)90074-J |
| [25] |
POUTANEN K, PULS J. Characteristics of Trichode-rma reesei β-xylosidase and its use in the hydrolysis of solubilized xylans[J]. Applied Microbiology and Biotechnology, 1988, 28(4/5): 425-432. |
| [26] |
KALLEL F, DRISS D, CHAARI F, et al. Statistical optimization of low-cost production of an acidic xylanase by Bacillus mojavensis UEB-FK:Its potential applications[J]. Biocatalysis and Agricultural Biotechnology, 2016, 5: 1-10. DOI:10.1016/j.bcab.2015.11.005 |
| [27] |
陈红歌, 朱静, 梁改芹, 等. 酸性木聚糖酶产生菌的筛选及产酶条件[J]. 微生物学报, 1999, 39(4): 350-354. CHEN H G, ZHU J, LIANG G Q, et al. Screening of acidic xylanase producing strain and studies on its enzyme production conditions[J]. Acta Microbiologica Sinica, 1999, 39(4): 350-354. |
| [28] |
王金华. 黑曲霉酸性木聚糖酶基因在毕赤酵母中的高效表达及其表达产物性质及应用特性研究[D]. 昆明: 云南师范大学, 2003. WANG J H.Cloning and overexpression of gene encoding acidic endo-β-1, 4-xylanase from Aspergillus niger (N402) in Pichia pastorisand analysis of properties of the recombinant xylanase[D].Kunming:Yunnan Normal University, 2003. |
| [29] |
FREDERICK M M, KIANG C, FREDERICK J R, et al. Purification and characterization of endo-xylanases from Aspergillus niger.Ⅰ.Two isozymes active on xylan backbones near branch points[J]. Biotechnology and Bioengineering, 1985, 27(4): 525-532. DOI:10.1002/(ISSN)1097-0290 |
| [30] |
TENKANEN H, PULS J, POUTANEN K. Two major xylanases of Trichoderma reesei[J]. Enzyme and Microbial Technology, 1992, 14(7): 566-574. DOI:10.1016/0141-0229(92)90128-B |
 2017, Vol. 24
2017, Vol. 24 


