2. 亚热带农业资源保护与利用国家重点实验室,广西南宁 530004
2. State Key Laboratory for Conservation and Utilization of Subtropical Agro-biore-sources, Nanning, Guangxi, 530004, China
【研究意义】木聚糖是由木糖通过木糖苷键将多个吡喃木糖基相连而成,主要可分为β-1, 4-木聚糖和β-1, 3-木聚糖[1-2]。内切木聚糖酶是目前研究较多、应用较广泛的木聚糖降解酶,在食品、造纸、饲料、酶法生产功能性低聚木糖工业等方面都起到重要的作用[3-5]。但是当前大多数木聚糖酶仍很难满足工业上的要求,因此对新的木聚糖酶基因资源的挖掘,对已有的酶在分子水平上进行改造,以满足工业上对不同性质酶的需求仍然是目前的研究热点。【前人研究进展】纤维微菌属是一类具有分解木质纤维素特性的放线菌。纤维微菌属 (Cellulosimicrobiumsp.) 在国外研究得比较多,但在国内还未见报道。OH Hyun-Woo等[6]报道从Cellulosimicrobiumsp.HY-12中纯化到大小为39 kDa、无纤维素酶活性的木聚糖酶,并测定相应的酶学性质。Kim Do Young等[7-8]报道从Cellulosimicrobiumsp. HY-13中纯化到大小为36 kDa、无纤维素酶活性的木聚糖酶,同时还克隆到glycoside hydrolase (GH) family 6 enzymes的木聚糖酶,其对p-nitrophenyl (PNP) cellobioside的转移酶活力达到788.3 IU/mg;Kamble等[9]报道从Cellulosimicrobium sp.MTCC 10645中纯化到大小为78 kDa、无纤维素酶活性的木聚糖酶,并测定其酶学性质。【本研究切入点】从环境中筛选出可水解木聚糖的酶资源,研究酶的基本性质,降低酶的生产成本,提高酶的转化效率。【拟解决的关键问题】以木聚糖为底物,从土壤中筛选出对木聚糖具有较高水解能力的野生菌,克隆其木聚糖基因并实现异源表达,再深入研究其酶学性质。
1 材料与方法 1.1 材料样品:从广西大学附近较多秸秆腐烂的地方采取土样,除去地表的覆盖土层,在地表下5~20 cm处取样。
菌株和载体:Escherichia coli BL21(DE3)、E.coliTrans10、pMD19-T、pET22b (+)。
酶和试剂:限制性内切酶和PCR扩增聚合酶购自大连TaKaRa公司,T4 DNA连接酶购自Toyobo公司;质粒提取试剂盒、DNA胶回收纯化试剂盒以及PCR产物纯化试剂盒购自Bio Flux公司;IPTG和X-gal购自Giboc公司;三硬脂酸甘油酯购自TCI公司;对硝基苯酚及对硝基苯酚酯底物购自Sigma公司;其他试剂均为国产分析纯。
1.2 培养基筛选培养基 (W/V):酵母粉1%,20%马铃薯汁10%,木聚糖1%,(NH4)2SO4 0.2%,MgSO4·7H2O 0.05%,KH2PO4 0.1%,NaCl 0.05%,明胶0.2%,琼脂1.5%。
发酵培养基 (W/V):酵母粉1%,20%马铃薯汁10%,木聚糖1%,(NH4)2SO4 0.2%,MgSO4·7H2O 0.05%,KH2PO4 0.1%,NaCl 0.05%。
种子培养基:胰蛋白胨10 g,NaCl 10 g,酵母提取物5 g,蒸馏水1 000 mL,pH值为7.0,121℃高温灭菌20 min。
液体发酵培养基:蛋白胨3 g,酵母粉0.5 g,(NH4)2SO42 g,K2HPO44 g,CaCl2·2H2O 0.3 g,MgSO4·7H2O 0.3 g,木聚糖10 g,加蒸馏水至1 000 mL,121℃高温灭菌20 min。
1.3 方法 1.3.1 产木聚糖酶菌株的筛选取10 mL土壤稀释液加入装有40 mL富集培养基的250 mL三角瓶中,于30℃,200 r/min摇床振荡培养48 h。取培养48 h的富集液10 mL转入新鲜的富集培养基中,于30℃,200 r/min摇床振荡培养48 h。再经木聚糖平板进行复筛,选取水解圈较大的菌落进行摇瓶培养,最终选取酶活力较高的菌株进行研究。
1.3.2 野生菌株16S rDNA鉴定以筛选出的野生菌总DNA (DNA提取方法参考文献[10]) 为模板,利用16S rDNA的通用引物进行PCR扩增反应,扩增产物连接pMD19-T载体后送测序,将测序获得的16S rDNA序列进行blastn分析。
1.3.3 木聚糖酶xyn-8a基因的克隆通过序列比对获得该酶保守区,并设计简并引物,扩增木聚糖酶基因xyn-8a中的部分序列。最终获得一段310 bp的DNA序列,NCBI网站blastn结果为内切木聚糖酶的部分序列。反向PCR测序结果拼接后NCBI比对结果表明该序列为内切木聚糖酶部分序列,在3′端缺少部分序列,继续以扩增获得的序列设计引物进行反向PCR最终获得完整编码的木聚糖酶基因。
1.3.4 木聚糖酶基因xyn-8a的构建在Signal P 4.1 Server网站进行信号肽分析及在SMART网站上进行结构域分析,去掉信号肽,设计xyn-8a表达引物同时引入Nco Ⅰ和EcoR Ⅰ酶切位点以及加入6组氨酸标签。引物序列如下:
xylp-6F:5′-CATGCCATGGATCACCATCATCATCATCATGCCGGCTCCACCCTCGAGGC-3′;
xylp-4R:5′-CCGGAATTCTCAGGCCGAGCAGGTGGCCGTC-3′。
用限制性内切酶EcoR Ⅰ和Hind Ⅲ双酶切载体和外源片段,试剂盒胶回收载体酶切产物及外源片段酶切产物。用T4连接酶将基因xyn-8a与表达载体连接过夜,将连接产物转化克隆宿主E.coliTrans10感受态细胞,涂布含200 μg/mL氨苄霉素的LB平板上,筛选并鉴定长出的单菌落。提取质粒酶切验证,并进行DNA序列测定。
1.3.5 木聚糖酶基因xyn-8a的表达将构建成功的重组质粒pET-xyn-8a在E.coliBL21(DE3) 中进行诱导表达中,37℃培养至OD600为0.4~0.6时,加终浓度为0.3 mmol/L的IPTG,37℃、200 r/min诱导8 h。SDS-PAGE分析其表达产物并进行后续的酶学性质测定。
1.3.6 木聚糖酶活力的测定木聚糖酶水解产生的木糖等还原糖能将碱性条件下的3,5-二硝基水杨酸还原,呈棕红色,于540 nm波长处有最大光吸收,在一定范围内还原糖的量与反应液的颜色深度呈线性关系,利用比色波长法测定其还原糖生成的量就可测定木聚糖酶的活力。在80 μL含有1%(W/V) Beechwood木聚糖缓冲液中加入20 μL适当稀释的酶液,在适当温度条件下反应10 min,然后加入400 μL的DNS溶液终止反应,反应结束后沸水浴5 min,迅速冷却,取200 μL反应液于96孔板中在540 nm波长下测定吸光度值,每组3个重复,计算木聚糖酶活力 (IU/mL)。酶活力单位 (IU) 定义:在最适条件下,每分钟水解底物生成1 μmol木糖所需的酶用量。比酶活定义:每毫克蛋白质所含的酶活力 (IU/mg)。
1.3.7 酶学性质的研究(1) pH值对酶活力的影响
取稀释的酶液,以1%(W/V) 的Beechwood木聚糖为底物,在40℃测定不同pH值的缓冲液[11](柠檬酸-磷酸氢二钠缓冲液:pH值2.0~7.5;Tris-HCl缓冲液:pH值7.5~8.5;甘氨酸-NaOH缓冲液:pH值8.5~10) 对木聚糖酶酶活力的影响,以最高酶活力为100%,绘制pH值-相对活力曲线。
(2) 温度对酶活力的影响
取稀释的酶液,以1%(W/V) 的Beechwood木聚糖为底物,在最适pH值的条件下,于不同温度下测定木聚糖酶的酶活力,以最高酶活力为100%,绘制温度-相对活力曲线。
(3) pH值耐受性的测定
用pH值2.5~10的缓冲液稀释纯酶,于4℃处理24 h,在最适条件下以1%(W/V) 的Beechwood木聚糖为底物测定残余活力,以未经处理的酶活力为100%,绘制pH稳定性曲线。
(4) 温度耐受性的测定
将纯化后的酶液经稀释后分别置于25℃、30℃、35℃、40℃、45℃、50℃、55℃、60℃恒温处理,隔一段时间取出酶液,在各自的最适条件下测其酶活力。以未经处理的酶液酶活力作为100%,绘制温度稳定性曲线。
(5) 木聚糖酶的底物特异性
以1%(W/V) 的山毛榉木木聚糖 (Beechwood xylan)、甘蔗渣木聚糖 (Bagasse xylan)、羧甲基纤维素钠 (Carboxymethylcellulose)、淀粉 (Soluble starch) 及结晶纤维素 (Avicel) 为底物,在最适条件下测定酶活力。
(6) 螯合剂、表面活性剂、还原剂和金属离子对酶的影响
在最适条件下,取经过稀释的纯酶与终浓度为5 mmol/L的金属离子Li+、Na+、Ag+、K+、Ba2+、Hg2+、Mn2+、Mg2+、Ca2+、Zn2+、Co2+、Cu2+、Fe2+以及终浓度为5 mmol/L的金属离子螯合剂EDTA、离子表面活性剂SDS和还原剂DTT、β-巯基乙醇进行反应,测定它们对酶活力的影响,以不添加影响因子的酶活力为100%,计算各种试剂对酶的相对酶活。
(7) 以Beechwood木聚糖或甘蔗渣木聚糖为底物时Km值和Vmax值的测定
在最适条件下,以Beechwood木聚糖或甘蔗渣木聚糖为底物,在不同底物浓度下测定木聚糖酶比活力。用GraphPad Prism 5软件进行分析。
(8) 木聚糖水解产物的鉴定与分析
以木糖xylose (X1),木二糖xylobiose (X2),木三糖xylotriose (X3) 为标准样,测定木聚糖水解产物 (以1%(W/V) Beechwood木聚糖和甘蔗渣木聚糖为底物,加入纯化的木聚糖酶在40℃作用24 h;然后将反应物沸水中煮沸10 min终止反应,室温冷却,12 000 r/min离心20 min)。使用安捷伦1100色谱仪进行HPLC分析,检测器为Alltech 200ES型蒸发光散色。色谱条件:色谱柱为Alltima Aminoz氨基柱 (4.6 mm×250 mm,5 μm);流动相为乙腈︰水 (75︰25);流速为1 mL/min;柱温为25℃。
2 结果与分析 2.1 产木聚糖酶菌株的筛选通过稀释平板法获得有透明圈的菌株23株,在以木聚糖为唯一碳源的筛选培养基上反复划线纯化,挑取生长良好且具有明显透明圈的菌株5株。进一步通过液体发酵复筛获得一株木聚糖酶产量相对较高的菌株,命名为XM-8。
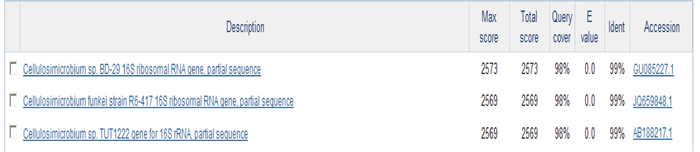
2.2 菌株的鉴定将获得菌株XM-8的16S rDNA基因序列在NCBI中比对,结果显示与原小单胞菌科的Cellulosimicrobiumsp.有最高的相似性为99%(图 1),结合菌株XM-8的形态特征 (菌落生长呈圆形,表面隆起,光滑湿润,呈黄色且不透明),将该菌株初步鉴定为Cellulosimicrobiumsp.。
|
图 1 16S rDNA序列比对结果 Fig.1 NCBI alignments results of 16S rDNA sequencing |
通过序列比对获得该酶保守区,并设计简并引物,扩增木聚糖酶基因xyn-8a中的部分序列,获得一段310 bp的DNA序列,NCBI网站blastn结果为内切木聚糖酶的部分序列。继续以扩增获得的序列设计引物进行反向PCR获得xyn-8a的完整ORF序列。
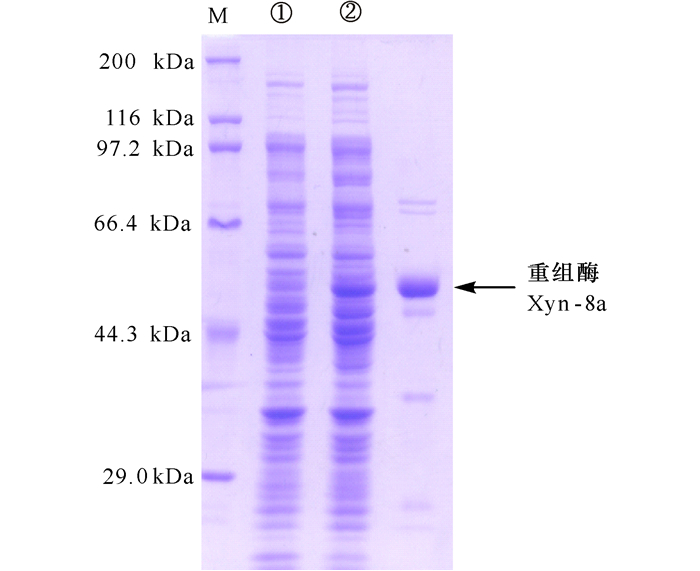
2.4 重组木聚糖酶的表达纯化将目的基因与表达载体连接构建Xyn-8a重组表达质粒,并导入大肠杆菌表达经镍柱亲和层析纯化后。SDS-PAGE电泳表明纯化的重组蛋白为较为单一的蛋白质条带 (图 2),纯度可以满足下一步酶学性质的研究分析。
|
M为蛋白质marker,①为未诱导菌体,②为诱导菌体 M: marker, ①Uninduced strains, ②Induced strain 图 2 纯化后重组酶Xyn-8a的SDS-PAGE电泳分析 Fig.2 Analysis of SDS-PAGE to the purified recombinant xylanase Xyn-8a |
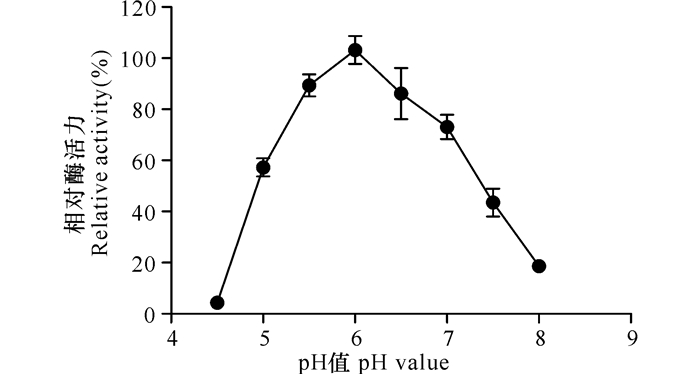
如图 3所示,在pH值为6.0时酶的活力最高,随着pH值的增加酶活力逐渐减少,在pH值为8时,重组酶Xyn-8a只保留30%以下的酶活力。而酶在pH值为5.5到7.0时能保持70%以上的相对酶活力,表明重组酶Xyn-8a是一种弱酸性酶。
|
图 3 pH值对木聚糖酶Xyn-8a酶活力的影响 Fig.3 Effects of pH on the β-1-4-xylanase activity of Xyn-8a |
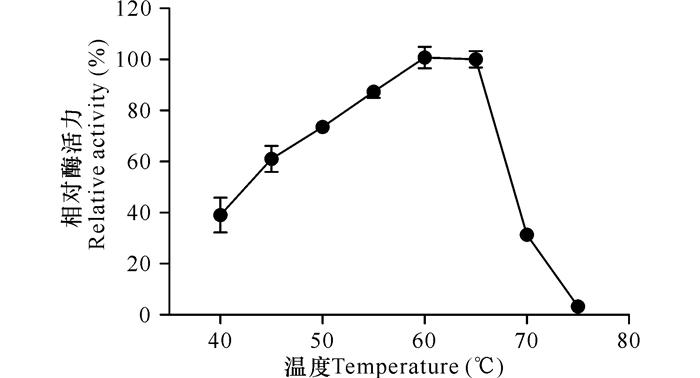
温度对于酶活的影响很大。木聚糖酶Xyn-8a的活性在温度为60℃时达到最大值,当温度超过65℃时,酶活力急剧下降,到75℃时酶完全失活 (图 4)。另外,从图 4中可以看出在45~65℃时,Xyn-8a酶的相对活性能保持在60%以上,说明该酶具有良好的工业应用潜力。
|
图 4 温度对Xyn-8a的影响 Fig.4 Effects of temperature on the β-1-4-xylanase activity of Xyn-8a |
Xyn-8a酶在pH值4~10、4℃条件下放置24 h仍有60%以上的相对活力,而在pH值7.5~10时相对活力保持在100%以上,表明Xyn-8a在偏碱性条件下更稳定,并且相对活性有所增加 (图 5),这对于Xyn-8a酶的保存十分有利。

|
图 5 Xyn-8a的pH稳定性 Fig.5 pH stability of Xyn-8a xylanase |
如图 6所示,Xyn-8a具有较好的温度稳定性,在40℃以下保存时几乎不损失活性,55℃处理8 h后仍有50%的酶活力;当温度达到60℃时,Xyn-8a酶的稳定性急剧下降,这意味着在Xyn-8a酶最适反应温度条件下 (60℃),反应不能持续太久。
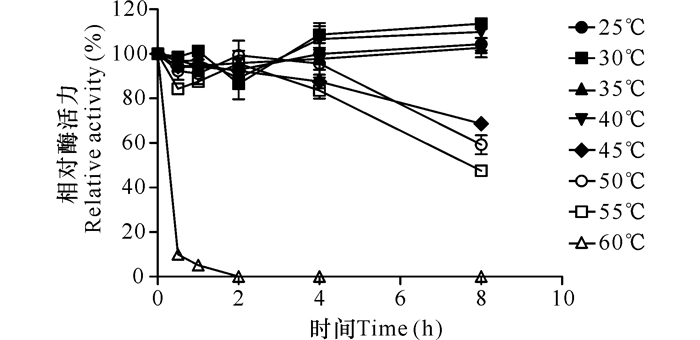
|
图 6 木聚糖酶Xyn-8a的热稳定性 Fig.6 Thermal stability of Xyn-8a xylanase |
如表 1所示,来自纤维微菌XM-8的Xyn-8a酶对木聚糖底物表现出很高的活性,而对其它底物如羧甲基纤维素等则不表现出活性,表明该重组酶为专一的木聚糖酶。因此在木聚糖底物纯度不高的情况下,使用Xyn-8a酶也能得到较高纯度的反应产物。
| 表 1 Xyn-8a底物特异性的分析 Table 1 Substrate specificity of the Xyn-8a |
在最适条件下,测定金属离子和化学试剂对酶活力的影响。如表 2所示,5 mmol/L的Mn2+、Pb2+、Cu2+对重组木聚糖酶Xyn-8a有较强的抑制作用,Fe2+、Co2+有轻微的抑制作用,而Mg2+、Ca2+、Ba2+、Ni2+和Zn2+则对酶有轻微的激活作用,由此可知在一般情况下重金属离子对Xyn-8a的酶活力有抑制作用。化学试剂SDS对酶影响显著,几乎造成酶完全失活。Na2EDTA对酶有轻微抑制,表明Xyn-8a酶的活性不完全依赖于金属离子的激活。β-巯基乙醇的影响则不明显。
| 表 2 5 mmol/L金属离子和化学试剂对Xyn-8a酶活力的影响 Table 2 Effects of 5 mmol/L metal ions and chemical reagent on the enzyme activity of Xyn-8a |
在最适条件下,以Beechwood木聚糖或甘蔗渣木聚糖为可溶性底物,在不同浓度下测定木聚糖酶比活力。用GraphPad Prism 5软件进行分析,如图 7所示。Xyn-8a以Beechwood木聚糖为可溶性底物时的Km(mg/mL) 值为3.48,Vmax(μmol·min-1·mg-1) 值为791.13,Kcat/Km(L·mol-1·s-1) 值为30 177.25;以甘蔗渣木聚糖为可溶性底物时的Km(mg/mL) 值为5.52,Vmax(μmol·min-1·mg-1) 值为1 122.08,Kcat/Km(L·mol-1·s-1) 值为26 982.46。
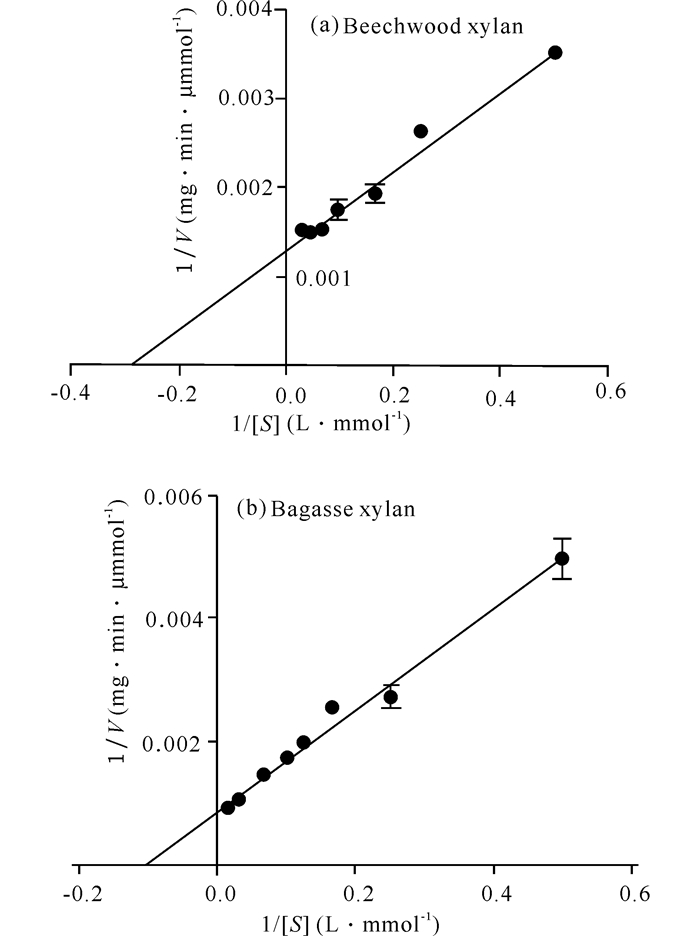
|
图 7 以Beechwood木聚糖或甘蔗渣木聚糖为底物时Xyn-8a的Lineweaver-Burk图 Fig.7 The Lineweaver-Burk of the recombinant Xyn-8a for Beechwood xylan or bagasse xylan |
如图 8所示,以Beechwood木聚糖和蔗渣木聚糖为底物,充分反应后使用HPLC法检测所生成的产物,结果显示反应产物均以木二糖为主 (71.07%),还存在少量的木糖 (7.78%) 及木三糖 (21.15%)。
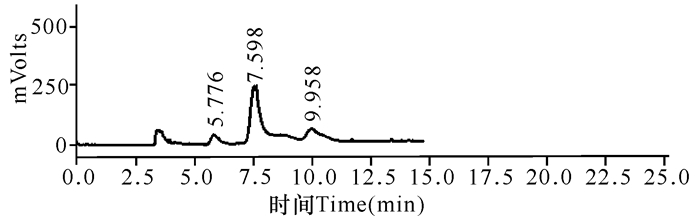
|
图 8 Xyn-8a水解木聚糖产物的HPLC图谱 Fig.8 HPLC chromatograms analysis of hydrolysis products on xylan hydrolyzed by Xyn-8a |
木聚糖酶在自然界中有广泛的分布,许多微生物如真菌、细菌、放线菌等都能合成木聚糖酶[12]。内切木聚糖酶作用于由β-1, 4-糖苷键相连的β-D-吡喃木糖主链,产生长度不同的低聚木糖和少量木糖[13],为降解木聚糖关键酶,而木糖苷酶主要作用于这些低聚木糖释放出木糖[14]。本研究从土壤中筛选到一株纤维微菌属产木聚糖酶菌株,酶学性质研究表明Xyn-8a的最适pH值为6.0,在pH值3.5~10.0时具有良好的稳定性;最适温度为60℃,具有较好的温度稳定性,在50℃处理8 h仍具有50%的酶活力。底物特异性单一,水解产物以木二糖为主,还含有少量的木三糖及木糖。这些性质表明木聚糖酶Xyn-8a在生物催化水解领域具有潜在的应用价值,可在造纸工业、生产功能性低聚木糖及促进动物肠道健康的饲料行业发挥重要的作用。
| [1] |
CHEN W P, MATSUO M, YASUI T. β-1, 3-Xylanase and β-1, 4-xylanase action on rhodymenan[J]. Agricultural and Biological Chemistry, 1986, 50(5): 1195-1200. |
| [2] |
OKAZAKI F, SHIRAKI K, TAMARU Y, et al. The first thermodynamic characterization of β-1, 3-xylanase from a marine bacterium[J]. The Protein Journal, 2005, 24(7/8): 413-421. |
| [3] |
石军, 陈安国. 木聚糖酶生产与应用研究进展[J]. 饲料工业, 2001, 22(9): 40-43. SHI J, CHEN A G. Progress in production and application of xylanase[J]. Feed Industry, 2001, 22(9): 40-43. |
| [4] |
吴香波, 谢益民. 木聚糖酶在制浆造纸工业中的应用和研究进展[J]. 华东纸业, 2008, 39(5): 6-9. WU X B, XIE Y M. Progress in research and application of xylanases in the pulping and paper industry[J]. Shanghai Paper Making, 2008, 39(5): 6-9. |
| [5] |
杨禄良. 木聚糖酶在饲料工业中的应用[C]//第四届中国动物营养与保健品国际研讨会论文集. 北京: 中国畜牧兽医学会, 2006. YANG L L.Application of xylanase in feed industry[C]//Fourth International Symposium on animal nutrition and health products in China.Beijing:China Animal Husbandry and Veterinary Institute, 2006. |
| [6] |
OH H W, HEO S Y, KIM D Y, et al. Biochemical characterization and sequence analysis of a xylanase produced by an exo-symbiotic bacterium of Gryllotalpa orientalis, Cellulosimicrobium sp.HY-12[J]. Antonie van Leeuwenhoek, 2008, 93(4): 437-442. DOI:10.1007/s10482-007-9210-2 |
| [7] |
KIM D Y, MI K H, LEE J S, et al. Isolation and characterization of a cellulase-free endo-β-1, 4-xylanase produced by an invertebrate-symbiotic bacterium, Cellulosimicrobiumsp[J]. Process Biochemistry, 2009, 44(9): 1055-1059. DOI:10.1016/j.procbio.2009.05.005 |
| [8] |
KIM D Y, HAM S J, KIM H J, et al. Novel modular endo-β-1, 4-xylanase with transglycosylation activity from Cellulosimicrobium sp.strain HY-13 that is homologous to inverting GH family 6 enzymes[J]. Bioresource Technology, 2012, 107: 25-32. DOI:10.1016/j.biortech.2011.12.106 |
| [9] |
KAMBLE R D, JADHAV A R. Production, purification and characterisation of alkali stable xylanase from Cellulosimicrobium sp.MTCC 10645[J]. Asian Pacific Journal of Tropical Biomedicine, 2012, 2(3): S1790-S1797. DOI:10.1016/S2221-1691(12)60496-1 |
| [10] |
姜淑梅, 张龙, 戴世鲲, 等. 一种简单、有效的适于PCR操作的放线菌DNA提取方法[J]. 生物技术, 2007, 17(1): 39-41. JIANG S M, ZHANG L, DAI S K, et al. A quick and efficient method for genomic DNA extraction from action bacteria[J]. Biotechnology, 2007, 17(1): 39-41. |
| [11] |
ÖSTLING S, VIRTAMA P. A modified preparation of the universal buffer described by teorell and stenhagen[J]. Acta Physiologica Scandinavica, 1946, 11(4): 289-293. DOI:10.1111/apha.1946.11.issue-4 |
| [12] |
孙超, 陈卫平. 微生物木聚糖酶及其应用研究进展[J]. 中国酿造, 2013, 32(4): 24-29. SUN C, CHEN W P. Research progress in microorganism xylanase and its application[J]. China Brewing, 2013, 32(4): 24-29. |
| [13] |
SIBTAIN A, SABA R, AMER J. Molecular cloning of fungal xylanases:An overview[J]. Applied Microbiology and Biotechnology, 2009, 84(1): 19-35. DOI:10.1007/s00253-009-2079-4 |
| [14] |
KNOB A, TERRASAN C R F, CARMONA E C. β-Xylosidases from filamentous fungi:An overview[J]. World Journal of Microbiology and Biotechnology, 2009, 26(3): 389-407. |
 2017, Vol. 24
2017, Vol. 24 


