2. 广西大学生命科学与技术学院,广西南宁 530004
2. College of Life Science and Technology, Guangxi University, Nanning, Guangxi, 530004, China
【研究意义】淀粉是葡萄糖分子由α-1,4或α-1,6糖苷键连接而成的聚合物,可分为直链淀粉和支链淀粉两种类型。淀粉是食品加工和酒精发酵工业中的重要原料,一方面,淀粉可以被水解用于生产葡萄糖、果糖以及果葡糖浆等[1];另一方面,淀粉被水解成葡萄糖后,可被酵母菌发酵产生酒精[2]。目前淀粉水解工艺中,主要是采用α-淀粉酶和糖化酶通过高温液化和高温糖化两步法对淀粉进行水解,在此过程中淀粉的糊化、液化及糖化需要高温蒸煮和连续加热,消耗大量能量并增加设备的投入,提高了产品的生产成本。
生淀粉酶是可以直接将未经蒸煮的生淀粉水解的一类酶,包括α-生淀粉酶、β-生淀粉酶和生淀粉糖化酶 (Raw starch-digesting glucoamylase, RSDG) 等。Robertson等[3]报道将生淀粉酶用于以淀粉质为原料的酒精生产中,可节省占所生产出的酒精的燃烧值10%~20%的能量消耗。而生淀粉糖化酶又可直接将生淀粉水解成葡萄糖。将淀粉的糊化、液化和糖化合为一步进行,省去传统复杂繁琐的淀粉处理工艺流程,能显著降低能耗和生产成本,因而具有较好的开发和应用前景。
【前人研究进展】目前报道较多的可以产生生淀粉糖化酶的微生物主要是真菌和酵母菌,人们对微生物的产酶条件的优化、酶的纯化、酶学特性及应用开展了广泛的研究[4]。Sun等[5]报道黑曲霉 (Aspergillus niger) 菌株F-08可分泌产生生淀粉糖化酶,在产酶培养基中加入麦芽糖作为诱导剂,可显著提高该酶的分泌表达水平。Flor等从泡盛曲霉 (Aspergillus awamori) 中分离纯化出生淀粉糖化酶GAO,并对其酶学性质进行鉴定[6];从罗尔伏革菌 (Corticium rolfsii) 中分离纯化出3种生淀粉糖化酶 (G1、G2、G3),鉴定了该3种生淀粉糖化酶的酶学性质,发现其最适pH值和最适温度均为4.5和60℃[7];从海洋酵母Aureobasidium pullulans中纯化出一种生淀粉糖化酶,该酶的最适pH值为4.5,最适温度为60℃,虽对不同生淀粉都有吸附能力,但只能水解生马铃薯淀粉[8]。目前报道的生淀粉糖化酶的活力并不高,而且对水解生淀粉的种类具有偏好性。
【本研究切入点】利用重组DNA技术构建基因工程菌可以有效提高蛋白质的产量,也有助于利用蛋白质工程技术对生淀粉糖化酶进行结构和功能的改造。然而,将生淀粉糖化酶基因进行异源有效表达以及对重组酶的酶学特性进行鉴定的研究报道并不多。本实验室从自然界中分离筛选到一株草酸青霉 (Penicillium oxalicum) 菌株GXU20,该菌株可分泌产生高活性的生淀粉糖化酶,从其发酵粗酶液中分离纯化了一种高活性的生淀粉糖化酶,对该酶的酶学性质进行了鉴定,克隆了该生淀粉糖化酶的编码基因并在毕赤酵母中实现了表达[9]。
【拟解决的关键问题】本研究对在毕赤酵母中表达的来源于草酸青霉的重组生淀粉糖化酶rPoGA15A的主要酶学特性进行鉴定,并与从草酸青霉GXU20中纯化的天然生淀粉糖化酶进行比较,为该酶的基因工程改造,以及在生淀粉的水解和生料同步糖化发酵中的应用提供依据。
1 材料与方法 1.1 材料大米、玉米、木薯、马铃薯、红薯、荞麦等生淀粉原材料均从广西南宁本地市场购买,经粉碎、过80目筛子后封装,送广西南宁南翔环保有限责任公司 (南宁辐照中心) Co60辐照灭菌备用。
可溶性淀粉购自Sigma-Aldrich公司;3, 5-二硝基水杨酸 (dinitrosalicylic acid,DNS) 购自国药集团化学试剂有限公司;Pierce BCA蛋白测定试剂盒购自Thermo Fisher Scientific公司,其他试剂均为分析纯。
多功能酶标仪 (美国BioTek公司)、LC-10AT高效液相色谱系统 (日本岛津公司)、小型垂直蛋白电泳槽及电泳仪 (美国Bio-Rad公司)、SU8020扫描电子显微镜 (日本日立公司)。
1.2 方法 1.2.1 重组生淀粉糖化酶的纯化将密码子优化后的生淀粉糖化酶基因连接到pPIC9k载体后,导入到毕赤酵母GS115中并已成功实现了生淀粉糖化酶基因的表达[9]。本研究将毕赤酵母诱导表达的培养液收集,12 000 r/min离心后取上清液,使用镍柱 (Ni-NTA Agarose) 对重组生淀粉糖化酶进行纯化,将上清液中的重组生淀粉糖化酶与Ni-NTA Agarose吸附后,用20 mmol/L、40 mmol/L、60 mmol/L、80 mmol/L、100 mmol/L浓度梯度的咪唑缓冲液进行洗脱,获得了纯化的重组生淀粉糖化酶rPoGA15A,备用。
1.2.2 重组生淀粉糖化酶酶活力的测定酶活力的测定用DNS法[10],即取450 μL含有1%生木薯粉、pH值为4.5的柠檬酸-磷酸氢二钠缓冲液,加入到2 mL EP管中,置于40℃水浴锅预热5 min,加入50 μL适当稀释的生淀粉糖化酶酶液,40℃下反应30 min,并不间断振荡EP管,反应结束后,立即加入1 000 μL DNS溶液,放置于沸水浴中5 min,冷却至室温后,12 000 r/min离心5 min,吸取200 μL上清液于540 nm处测定吸光值。依据葡萄糖标准曲线计算出酶活力大小。
生淀粉糖化酶酶活力的定义:在40℃pH值为4.5条件下,重组生淀粉糖化酶水解生淀粉1 min产生1 μmol还原糖 (相当于等量的葡萄糖) 所需要的酶量为一个酶活力单位 (U)。
1.2.3 重组生淀粉糖化酶最适pH值的测定在37℃下,测定重组生淀粉糖化酶在pH值分别为3.0,3.5,4.0,4.5,5.0,5.5,6.0,6.5,7.0时的酶活力。使用的缓冲液为柠檬酸-磷酸氢二钠缓冲液 (pH值为3.0~7.0)。将测定得到的酶活力最高的pH值下的酶活力作为100%,其它pH值下的酶活力与最高酶活力之间的百分比为重组生淀粉糖化酶在该pH值条件下的相对酶活力 (%)。
1.2.4 重组生淀粉糖化酶最适温度的测定在最适pH值 (pH值为4.5) 下,测定重组生淀粉糖化酶的最适作用温度。将酶液与含1%生木薯粉的柠檬酸-磷酸氢二钠缓冲液 (pH值为4.5) 混合,分别在30℃、35℃、40℃、45℃、50℃、55℃、60℃、65℃、70℃、75℃、80℃下反应30 min,DNS法检测酶活力。以酶活力最高的温度下的酶活力作为100%,其它温度下的酶活力与最高酶活力之间的百分比为重组生淀粉糖化酶在该温度条件下的相对酶活力 (%)。
1.2.5 重组生淀粉糖化酶pH耐受性的测定取50 μL适当稀释的纯化的重组酶液与450 μL的一系列不同pH值缓冲液 (2.0~11.0) 混合,使用的缓冲液分别为0.1 mol/L柠檬酸-磷酸氢二钠 (pH值为2.0~7.0)、磷酸盐缓冲液 (pH值为7.0~8.0)、Tris-HCl (pH值为8.0~9.0)、Glycine-NaOH (pH值为9.0~11.0)。将混合后的酶液在4℃冰箱中放置24 h后,检测残留的重组生淀粉糖化酶活力。测定未作pH值耐受处理前的原始酶活力,将其定义为100%,处理后的残留酶活力与原始酶活力的百分比即为该pH值下的相对酶活力 (%)。
1.2.6 重组生淀粉糖化酶温度耐受性的测定将纯化的重组酶液与柠檬酸-磷酸氢二钠缓冲液 (pH值为4.5) 混合,放置于不同温度 (30℃、35℃、40℃、45℃、50℃、55℃、60℃、65℃、70℃、75℃、80℃) 的水浴锅中保温60 min之后,用DNS法测定残余的酶活力。测定未作温度处理前的原始酶活力,将其定义为100%,处理后的残留酶活力与原始酶活力的百分比即为该温度下的相对酶活力 (%)。
1.2.7 金属离子、表面活性剂、螯合剂对重组生淀粉糖化酶活力的影响分别向含有1%生木薯粉、pH值为4.5的柠檬酸-磷酸氢二钠缓冲液中加入各种金属离子、表面活性剂、螯合剂并充分混匀,使各种添加物终浓度为10 mmol/L,40℃下测定酶活。将无上述添加物时的酶活力定义为100%,添加各化学试剂处理后的酶活力与无添加物的酶活力的百分比即为该添加物下的相对酶活力 (%)。
1.2.8 重组生淀粉糖化酶的底物特异性分别配制含1%不同来源的生粉及可溶性淀粉的pH值为4.5的柠檬酸-磷酸氢二钠缓冲液,在40℃下测定酶活力。将生木薯粉为底物测得的酶活力定义为100%,其它淀粉的酶活力与生木薯粉的酶活力之间的百分比为重组生淀粉糖化酶对该生淀粉的相对酶活力 (%)。
1.2.9 重组生淀粉糖化酶的吸附特性取纯化的重组生淀粉糖化酶液分别加入到含有1%和5%生粉的pH值4.5柠檬酸-磷酸氢二钠缓冲液中并充分混匀,放入40℃水浴锅中保温30 min,期间不时地振荡EP管。吸附完成后,8 000×g离心5 min,取出上清液测定酶活力,同时测定相同条件下无生淀粉的对照的酶活力。生淀粉糖化酶吸附率的计算根据以下公式:吸附率 (%)=(A-B)×100/A,其中A代表无生淀粉的对照的酶活力,B代表吸附作用之后上清液中残留重组酶的酶活力[11]。
1.2.10 重组生淀粉糖化酶水解生木薯粉产物的HPLC检测取纯化的重组生淀粉糖化酶液100 μL加入到500 μL含2%生木薯粉的柠檬酸-磷酸氢二钠缓冲液 (pH值4.5) 中,充分混合后,40℃下反应并不间断振荡反应液。反应4 h后,12 000 r/min离心5 min,取上清液过0.22 μm的滤膜。取水解液进行高效液相色谱 (High performance liquid chromatography, HPLC) 检测,使用的HPLC型号为岛津公司的LC-10AT型,并串联了示差检测器。使用色谱柱为Benson Polymeric公司7.8 mm×300 mm的糖柱,柱温设定为80℃,以超纯水作为流动相,流速为1 mL/min,进样体积为20 μL,检测时长为20 min。
1.2.11 重组生淀粉糖化酶降解生淀粉颗粒的扫描电镜观察分别配制含2%生木薯粉,生玉米粉,生大米粉、生马铃薯粉的pH值4.5的柠檬酸缓冲液,分别向上述生淀粉溶液中加入纯化后的重组生淀粉糖化酶,置于40℃水浴锅中反应,并不间断振荡反应液,反应8 h后,将反应液在10 000 r/min离心10 min,向离心后的沉淀物中加入无水乙醇洗涤,干燥处理后用扫描电子显微镜观察。
1.2.12 重组生淀粉糖化酶对不同种类生淀粉的水解分别配制含10 g/L大米、玉米、木薯、马铃薯生粉的柠檬酸-磷酸氢二钠缓冲液 (pH值4.5),按0.2 U重组生淀粉酶/mg生淀粉的酶用量,分别向上述不同种类的生粉底物中加入纯化后的重组生淀粉糖化酶rPoGA15A,40℃振荡水浴锅中反应,分别于12 h、24 h、36 h、48 h、60 h、72 h取样,DNS法测定上清中的还原糖含量,计算水解率百分比,计算公式:Rh=(A1/A0)×0.9×100,其中Rh代表生淀粉的水解百分比;A1代表重组生淀粉糖化酶水解淀粉后,上清液中还原糖的含量;A0代表水解反应前,总淀粉的含量[12]。总淀粉含量的测定方法参照Lin等[13-14]的方法。
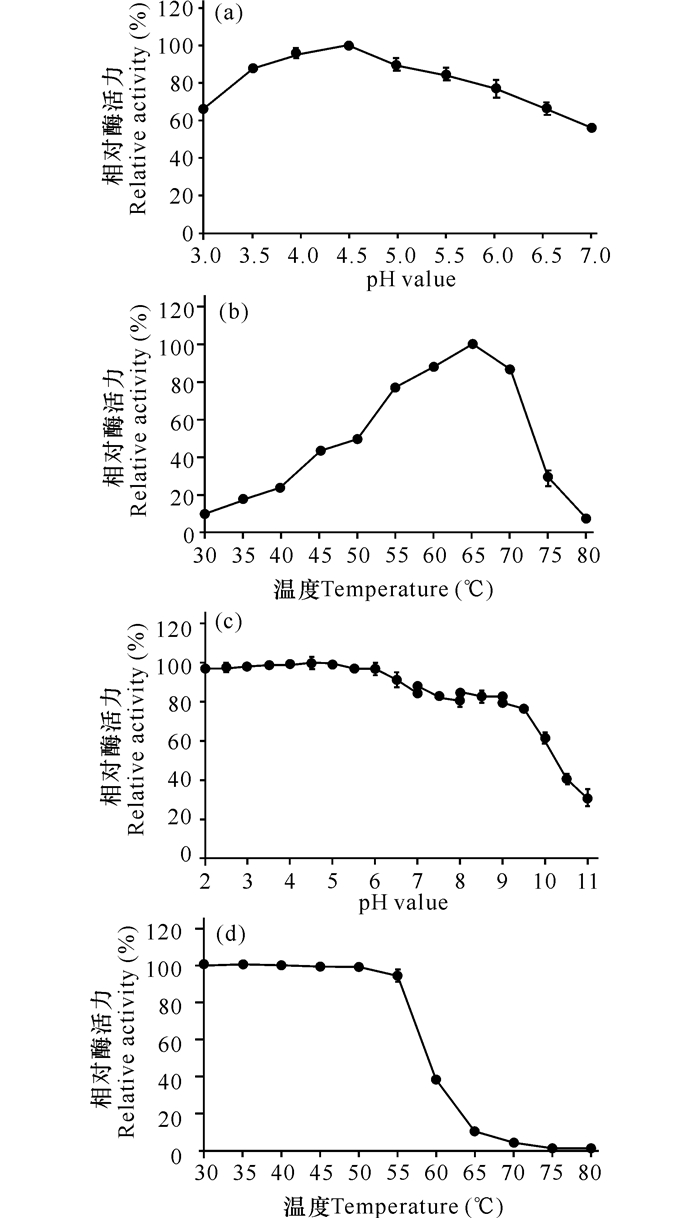
2 结果与分析 2.1 pH值对重组生淀粉糖化酶rPoGA15A酶活力的影响草酸青霉菌株GXU20生淀粉糖化酶基因PoGA15A,在毕赤酵母中进行了表达,并对表达产物进行了纯化[9],本研究对纯化的该重组生淀粉糖化酶的酶学性质进行鉴定。重组生淀粉糖化酶最适pH值,结果见图 1a。当pH值为3.0时,重组生淀粉糖化酶的酶活力约为最高酶活力的66%;随着pH值的升高,酶活力也逐渐随之提高;pH值在3.5~5.5时酶活力较高,达到85%以上;pH值为4.5时酶活力最高,表明重组酶的最适pH值为4.5;pH值大于4.5,酶活力逐渐下降。
|
(a) pH值对酶活力的影响; (b) 温度对酶活力的影响; (c) pH值对重组酶稳定性的影响; (d) 温度对重组酶稳定性的影响 (a) Effects of pH on the enzyme activity; (b) Effects of temperature on the enzyme activity; (c) Effects of pH on the enzyme stability; (d) Effects of temperature on the enzyme stability 图 1 pH值和温度对草酸青霉GXU20的重组生淀粉糖化酶rPoGA15A酶活力和稳定性的影响 Fig.1 Effects of pH and temperature on the enzyme activity of the recombinant raw starch-digesting glucoamylase rPoGA15A from P.oxalicum GXU20 |
结果如图 1b所示,重组生淀粉糖化酶活力随着温度的升高逐渐升高,65℃时,酶活力达到最大,表明重组酶的最适温度为65℃,65℃以上酶活力逐渐下降。主要原因可能是高温破坏了酶分子的结构,使蛋白丧失了酶活力。
2.3 pH值对重组生淀粉糖化酶rPoGA15A稳定性的影响结果如图 1c所示, 在较低的pH值 (2.0~6.0) 范围内,重组生淀粉糖化酶很稳定,酶活力几乎没有丧失,随着pH值的逐渐升高,酶活力略有下降,但基本上保持在85%左右,当pH值大于10.0后,酶活力开始显著下降。总体来说,重组生淀粉糖化酶具有较好的pH耐受性。一方面,说明重组生淀粉糖化酶在pH值为2.0~10.0时的稳定性较好,另一方面,在极低的pH值条件下 (2.0~3.0),重组生淀粉糖化酶仍保留了绝大部分的酶活力,耐酸性环境的能力较好,在同步糖化发酵工艺中,能够较好地适应酿酒酵母的酸性发酵条件[15]。
2.4 温度对重组生淀粉糖化酶rPoGA15A稳定性的影响结果如图 1d所示,在30~50℃时,没有发生酶活力的损失,生淀粉糖化酶的耐受性好。55℃时,酶活力开始降低。当温度高于55℃时,酶活力开始快速下降。
2.5 金属离子及化学试剂对重组生淀粉糖化酶rPoGA15A的影响结果如表 1所示,Mn2+和Fe2+对重组生淀粉糖化酶有促进作用,Ca2+、K+、Na+、Mg2+、Li+、Co2+等离子对重组酶的活力影响不大,Ag+重金属离子能够显著抑制酶活力,Cu2+对酶活也有抑制作用。变性剂SDS对酶也具有显著的抑制作用,金属螯合剂EDTA对重组酶有微弱促进作用,表面活性剂Tween 80和Triton X-100对酶活力基本没有影响。
| 表 1 金属离子及化学试剂对重组生淀粉糖化酶rPoGA15A酶活力的影响 Table 1 Effects of metal ions and other chemical reagents on the enzyme activity of the recombinant raw starch-digesting glucoamylase rPoGA15A |
结果如表 2所示,重组生淀粉糖化酶可水解所测定的不同淀粉。对生大米淀粉的比活力最高,约为生木薯淀粉活力的221%;对生玉米淀粉的活力与对生大米淀粉的活力相近,对生木薯淀粉、生马铃薯淀粉、生荞麦淀粉的活力逐渐降低,对生红薯淀粉的活力最低。重组酶对可溶性淀粉的活力在所有测定淀粉中最高,大约分别是生大米淀粉和生木薯淀粉活力的3.2倍和7.2倍。
| 表 2 重组生淀粉糖化酶rPoGA15A对不同种类淀粉的底物特异性 Table 2 Substrate specificity of the recombinant raw starch-digesting glucoamylase rPoGA15A towards various starches |
由表 3可以看出,重组生淀粉糖化酶rPoGA15A对4种生淀粉都有不同程度的吸附能力,对同一种生淀粉的吸附能力随着生淀粉浓度的增加而增加,其中对生大米淀粉的吸附率最高,生玉米、木薯淀粉次之,生马铃薯淀粉吸附力最低,这与该酶对上述4种淀粉的比活力大小的次序相一致,表明重组生淀粉糖化酶rPoGA15A对生淀粉的水解能力与吸附能力有一定的正相关性。
| 表 3 重组生淀粉糖化酶rPoGA15A对不同生淀粉的吸附 Table 3 Adsorbability of the recombinant raw starch-digesting glucoamylase rPoGA15A towards different raw starches |
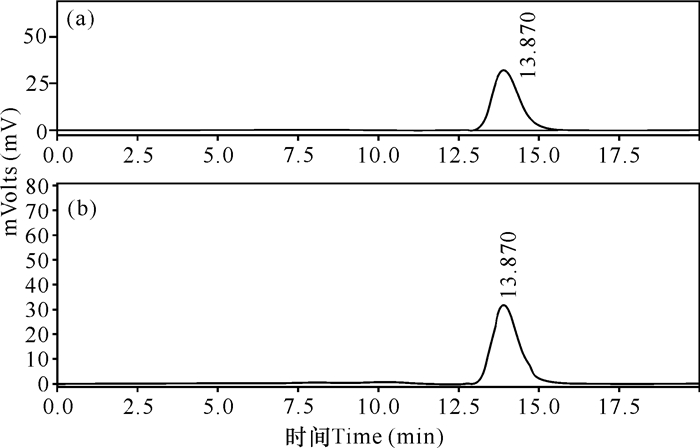
检测结果从图 2可以看出,水解4 h后,在HPLC图谱中13.87 min位置出现了唯一的色谱峰 (图 2b),与葡萄糖标准样品的色谱峰一致 (图 2a),表明重组酶水解生木薯淀粉生成的产物仅有葡萄糖,证实该酶是生淀粉糖化酶。上述结果表明重组酶的酶学特性和天然酶的酶学特性[9]相似,说明生淀粉糖化酶基因PoGA15A在毕赤酵母中得到了正确表达。
|
(a) 葡萄糖标准品;(b) 重组生淀粉糖化酶rPoGA15A的生木薯淀粉水解液 (a) Glucose standard; (b) The reaction mixture of raw cassava starch hydrolyzed by the recombinant raw starch-digesting glucoamylase rPoGA15A 图 2 重组生淀粉糖化酶rPoGA15A水解生木薯淀粉的产物的HPLC分析图谱 Fig.2 HPLC chromatograms of hydrolysate of raw cassava starch by the recombinant raw starch-digesting glucoamylase rPoGA15A from P.oxalicumGXU20 |
如图 3所示,未经酶处理的生大米淀粉颗粒形状不规则,呈棱角状;酶处理后,淀粉颗粒表面出现许多小的孔洞,逐渐向内部延伸 (图 3a~b)。未经酶处理的生玉米淀粉颗粒形状似圆球形,表面光滑平整;酶处理后的淀粉颗粒出现大量大小不一的小孔洞,而且孔洞较深 (图 3c~d)。未经酶处理的生木薯淀粉颗粒似圆球形;酶处理后的淀粉颗粒出现一个较大的孔洞,沿着孔洞,逐步向颗粒内部侵蚀,颗粒内部表面高低起伏 (图 3e~f)。未经酶处理的生马铃薯淀粉颗粒形状似椭圆形;酶处理后的淀粉颗粒表面出现狭长状的侵蚀沟,有的侵蚀沟会向内部扩展,形成孔洞 (图 3g~h)。

|
(a) 未被酶处理的生大米淀粉颗粒;(b) rPoGA15A处理后的生大米淀粉颗粒;(c) 未被酶处理的生玉米淀粉颗粒;(d) rPoGA15A处理后的生玉米淀粉颗粒;(e) 未被酶处理的生木薯淀粉颗粒;(f) rPoGA15A处理后的生木薯淀粉颗粒;(g) 未被酶处理的生马铃薯淀粉颗粒;(h) rPoGA15A处理后的生马铃薯淀粉颗粒 (a) Native raw rice starch granules; (b) Raw rice starch granules digested by the enzyme rPoGA15A; (c) Native raw corn starch granules; (d) Raw corn starch granules digested by the enzyme rPoGA15A; (e) Native raw cassava starch granule; (f) Raw cassava starch granules digested by the enzyme rPoGA15A; (g) Native raw potato starch granule; (h) Raw potato starch granules digested by the enzyme rPoGA15A 图 3 草酸青霉GXU20的重组生淀粉糖化酶rPoGA15A水解不同生淀粉颗粒的扫描电镜观察 Fig.3 Scanning electron microscopy (SEM) analysis of different raw starch granules hydrolyzed by the recombinant raw starch-digesting glucoamylase rPoGA15A from P.oxalicumGXU20 |
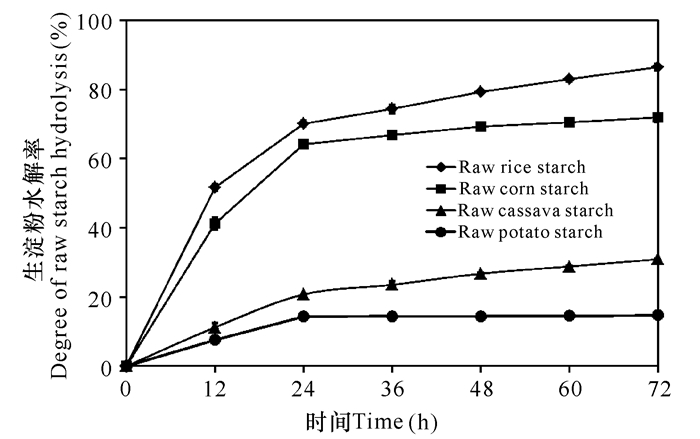
结果如图 4所示,重组生淀粉糖化酶rPoGA15A对生大米淀粉的水解效果最好,随着水解作用时间的增加,水解率逐渐升高,72 h后水解率达到86.5%;对生玉米淀粉的水解效果次之,72 h后水解率达到71.9%;72 h后对生木薯淀粉的水解率为30.9%;72 h后对生马铃薯淀粉的水解率为14.8%。重组生淀粉糖化酶对上述生淀粉的水解主要发生在24 h前。
|
图 4 重组生淀粉糖化酶rPoGA15A对10 g/L的不同来源生粉中的生淀粉的水解 Fig.4 Hydrolysis of the recombinant raw starch-digesting glucoamylase rPoGA15A towards raw starches from different flours at the concentration of 10 g/L |
本研究对在毕赤酵母中表达的来源于草酸青霉的生淀粉糖化酶的酶学性质进行了鉴定。重组生淀粉糖化酶rPoGA15A的最适pH值为4.5,与来源于黑曲霉 (Aspergillus niger) 的生淀粉糖化酶的最适pH值相似[16],略低于来源于柄篮状菌 (Talaromyces stipitatus) 的重组生淀粉糖化酶最适pH值[17];最适温度为65℃,和来源于柄篮状菌的重组生淀粉糖化酶最适温度相似[17];pH耐受性较好,与草酸青霉产生的天然生淀粉糖化酶PoGA15A的pH耐受性相似[9],有利于该重组酶在生淀粉的水解和生料同步糖化发酵生产酒精工业中的应用。
Mn2+和Fe2+对重组生淀粉糖化酶rPoGA15A的酶活力有促进作用,Ag+、Cu2+和SDS对酶活力有抑制作用,与对来源于草酸青霉的天然生淀粉糖化酶的影响相似[9]。重组生淀粉糖化酶rPoGA15A可水解不同来源的生淀粉,对大米、玉米、木薯、马铃薯、荞麦和红薯生淀粉的活力逐渐下降,来源于青霉属 (Penicillium sp.) 的生淀粉糖化酶对玉米和大米的活性比对其他生淀粉的活性高,与本研究的结果相似[18],与之相反,来源于耐热真菌Thermomucor indicae-seudaticae的生淀粉糖化酶对生大米淀粉的活力最低[19]。重组生淀粉糖化酶rPoGA15A对大米和玉米生淀粉的吸附能力最强,这与Quigley等[20]报道的来源于Cladosporium gossypiicola ATCC 38026的生淀粉糖化酶相似。
扫描电镜观察发现重组生淀粉糖化酶rPoGA15A对不同生淀粉颗粒的降解方式各有特点,在玉米和大米淀粉颗粒的表面形成许多小的孔洞,和来源于Cladosporium gossypiicola的生淀粉糖化酶水解方式相似[20]。重组生淀粉糖化酶rPoGA15A对马铃薯淀粉颗粒的水解方式与来源于Aspergillus awamori的生淀粉酶对马铃薯生淀粉的水解方式相似[21]。重组生淀粉糖化酶rPoGA15A降解木薯淀粉颗粒形成较大的孔洞,其水解方式与天然生淀粉糖化酶PoGA15A的水解方式一致[9]。生淀粉糖化酶rPoGA15A对大米和玉米生淀粉的水解率要显著高于对木薯和马铃薯生淀粉的水解率,这与Nagasaka等[7]报道的来源于罗尔伏革菌 (Corticium rolfsii) 的生淀粉糖化酶G1在40℃条件下对2%上述生淀粉的水解性质较为类似,可能原因是不同来源的生淀粉的组成和结构差异所致。重组生淀粉糖化酶rPoGA15A对大米和玉米生淀粉的水解效果较好,不需要高温处理淀粉的情况下,在40℃下可以直接将生淀粉水解生成葡萄糖,节省了能量消耗成本,因而,该酶具有一定的应用前景。总的来说,重组生淀粉糖化酶rPoGA15A的酶学性质与草酸青霉分泌的天然生淀粉糖化酶PoGA15A的酶学性质相似,也表明草酸青霉生淀粉糖化酶基因在毕赤酵母中得到了正确的表达。
4 结论本研究对在毕赤酵母中表达的来源于草酸青霉的重组生淀粉糖化酶rPoGA15A进行了酶学性质的鉴定。重组生淀粉糖化酶rPoGA15A的最适pH值为4.5,最适温度为65℃,在pH值为2.0~10.0时,重组酶具有较好的稳定性,pH耐受范围广;温度小于50℃时,酶的稳定性好。除Ag+、Cu2+和SDS之外,其他大部分金属离子和化学试剂对重组酶的酶活力影响不大。重组生淀粉糖化酶对大米和玉米生淀粉的活性较高,对木薯和马铃薯生淀粉的活性次之,重组生淀粉糖化酶rPoGA15A对不同生淀粉的吸附能力与对不同生淀粉水解活性大小呈正相关性。扫描电镜观察表明重组生淀粉糖化酶对不同生淀粉颗粒的降解作用明显,水解方式也有所不同。40℃条件下,重组生淀粉糖化酶rPoGA15A对大米和玉米生淀粉水解率较高,水解效果好,具有一定的应用前景。
| [1] |
ŠOKARDA SLAVIĆ M, PEŠIĆ M, VUJĆIĆ Z, et al. Overcoming hydrolysis of raw corn starch under industrial conditions with Bacillus licheniformis ATCC 9945a α-amylase[J]. Applied Microbiology and Biotechnology, 2016, 100(6): 2709-2719. DOI:10.1007/s00253-015-7101-4 |
| [2] |
FAVARO L, VIKTOR M J, ROSE S H, et al. Consolidated bioprocessing of starchy substrates into ethanol by industrial Saccharomyces cerevisiae strains secreting fungal amylases[J]. Biotechnology and Bioengineering, 2015, 112(9): 1751-1760. DOI:10.1002/bit.25591 |
| [3] |
ROBERTSON G H, WONG D W S, LEE C C, et al. Native or raw starch digestion:A key step in energy efficient biorefining of grain[J]. Journal of Agricultural and Food Chemistry, 2006, 54(2): 353-365. DOI:10.1021/jf051883m |
| [4] |
SUN H Y, ZHAO P J, GE X Y, et al. Recent advances in microbial raw starch degrading enzymes[J]. Applied Biochemistry and Biotechnology, 2010, 160(4): 988-1003. DOI:10.1007/s12010-009-8579-y |
| [5] |
SUN H Y, ZHAO P J, PENG M. Application of maltitol to improve production of raw starch digesting glucoamylase by Aspergillus niger F-08[J]. World Journal of Microbiology and Biotechnology, 2008, 24(11): 2613-2618. DOI:10.1007/s11274-008-9785-4 |
| [6] |
FLOR P Q, HAYASHIDA S. Production and characteristics of raw starch-digesting glucoamylase O from a protease-negative, glycosidase-negative Aspergillus awamori var.kawachi mutant[J]. Applied and Environment Microbiology, 1983, 45(3): 905-912. |
| [7] |
NAGASAKA Y, KUROSAWA K, YOKOTA A, et al. Purification and properties of the raw-starch-digesting glucoamylases from Corticium rolfsii[J]. Applied Microbiology and Biotechnology, 1998, 50(3): 323-330. DOI:10.1007/s002530051299 |
| [8] |
LI H F, CHI Z M, WANG X H, et al. Purification and characterization of extracellular amylase from the marine yeast Aureobasidium pullulans N13d and its raw potato starch digestion[J]. Enzyme and Microbial Technology, 2007, 40(5): 1006-1012. DOI:10.1016/j.enzmictec.2006.07.036 |
| [9] |
XU Q S, YAN Y S, FENG J X. Efficient hydrolysis of raw starch and ethanol fermentation:A novel raw starch-digesting glucoamylase from Penicillium oxalicum[J]. Biotechnology for Biofuels, 2016, 9(1): 216. DOI:10.1186/s13068-016-0636-5 |
| [10] |
MILLER G L. Use of dinitrosalicylic acid reagent for determination of reducing sugar[J]. Analytical Chemistry, 1959, 31(3): 426-428. DOI:10.1021/ac60147a030 |
| [11] |
BOŽIĆ N, RUIZ J, LÓPEZ-SANTÍN J, et al. Production and properties of the highly efficient raw starch digesting α-amylase from a Bacillus licheniformis ATCC 9945a[J]. Biochemical Engineering Journal, 2011, 53(2): 203-209. DOI:10.1016/j.bej.2010.10.014 |
| [12] |
SHAFIEI M, ZIAEE A A, AMOOZEGAR M A. Purification and biochemical characterization of a novel SDS and surfactant stable, raw starch digesting, and halophilic α-amylase from a moderately halophilic bacterium, Nesterenkonia sp.strain F[J]. Process Biochemistry, 2010, 45(5): 694-699. DOI:10.1016/j.procbio.2010.01.003 |
| [13] |
LIN H J, XIAN L, ZHANG Q J, et al. Production of raw cassava starch-degrading enzyme by Penicillium and its use in conversion of raw cassava flour to ethanol[J]. Journal of Industrial Microbiology & Biotechnology, 2011, 38(6): 733-742. |
| [14] |
MOON S K, KIM S W, CHOI G W. Simultaneous saccharification and continuous fermentation of sludge-containing mash for bioethanol production by Saccharomyces cerevisiae CHFY0321[J]. Journal of Biotechnology, 2012, 157(4): 584-589. DOI:10.1016/j.jbiotec.2011.06.009 |
| [15] |
ZHANG L, ZHAO H, GAN M Z, et al. Application of simultaneous saccharification and fermentation (SSF) from viscosity reducing of raw sweet potato for bioethanol production at laboratory, pilot and industrial scales[J]. Bioresource Technology, 2011, 102(6): 4573-4579. DOI:10.1016/j.biortech.2010.12.115 |
| [16] |
AMIRUL A A, KHOO S L, NAZALAN M N, et al. Purification and properties of two forms of glucoamylase from Aspergillus niger[J]. Folia Microbiologica, 1996, 41(2): 165-174. DOI:10.1007/BF02814694 |
| [17] |
XIAO Z Z, WU M Q, GROSSE S, et al. Genome mining for new α-amylase and glucoamylase encoding sequences and high level expression of a glucoamylase from Talaromyces stipitatus for potential raw starch hydrolysis[J]. Applied Biochemistry and Biotechnology, 2014, 172(1): 73-86. DOI:10.1007/s12010-013-0460-3 |
| [18] |
SUN H Y, GE X Y, ZHANG W G. Production of a novel raw-starch-digesting glucoamylase by Penicillium sp.X-1 under solid state fermentation and its use in direct hydrolysis of raw starch[J]. World Journal of Microbiology and Biotechnology, 2007, 23(5): 603-613. DOI:10.1007/s11274-006-9269-3 |
| [19] |
KUMAR S, SATYANARAYANA T. Purification and kinetics of a raw starch-hydrolyzing, thermostable, and neutral glucoamylase of the thermophilic mold Thermomucor indicae-seudaticae[J]. Biotechnology Progress, 2003, 19(3): 936-944. DOI:10.1021/bp034012a |
| [20] |
QUIGLEY T A, KELLY C T, DOYLE E M, et al. Patterns of raw starch digestion by the glucoamylase of Cladosporium gossypiicola ATCC 38026[J]. Process Biochemistry, 1998, 33(6): 677-681. DOI:10.1016/S0032-9592(98)00036-3 |
| [21] |
MATSUBARA T, BEN AMMAR Y, ANINDYAWATI T, et al. Degradation of raw starch granules by α-amylase purified from culture of Aspergillus awamori KT-11[J]. Journal of Biochemistry and Molecular Biology, 2004, 37(4): 422-428. |
 2017, Vol. 24
2017, Vol. 24 


