随着人口老龄化及人们生活方式的改变,血栓类疾病变得日益严重,持续地危害人类健康,是一种发病率、致死率、致残率较高的疾病。据世界卫生组织统计,全世界每年约有2 600万人因血栓类疾病死亡,我国心脑血管疾病死亡人数占因病死亡总人数的40.7%,居死因之首[1]。常见的血栓类疾病类型有脑血栓栓塞、肺静脉栓塞、心腔附壁血栓、外周动脉血栓和缺血性休克[2]等。其中,心腔附壁血栓病症之一的急性心肌梗塞 (AMI) 致死率高达30%[2]。所以血栓类疾病治疗的相关研究已成为医药学界的研究热点,溶栓类药物在血栓治疗过程中被广泛使用。本文概述了溶栓药物近年来研究进展,指出获得溶栓效率高、特异性强、成本低的新型天然溶栓药物是血栓类疾病今后的重要研究方向。
1 血栓类型、形成机制及溶栓酶溶栓机制 1.1 血栓的类型根据组成可将血栓分类成红色血栓、白色血栓、混合血栓及透明血栓[3]。红色血栓 (Red thrombus) 的形成过程类似血管外凝血过程,主要存在于局部血流十分缓慢乃至停止流动处,形成延续性血栓 (Propagating thrombus) 的尾部[4]。白色血栓 (Pale thrombus) 主要形成在血流较快处,构成延续性血栓的头部。混合血栓 (Mixed thrombus) 在结构上可分为头、体、尾3部分,头部由白色血栓形成,体部由红色血栓与白色血栓组成,尾部由红色血栓组成。血栓头部常黏附于血管壁,形成附壁血栓[4]。透明血栓 (Hyaline thrombus) 只在微小血管中存在,为弥散性血管内凝血的构成,也称微血栓[4]。
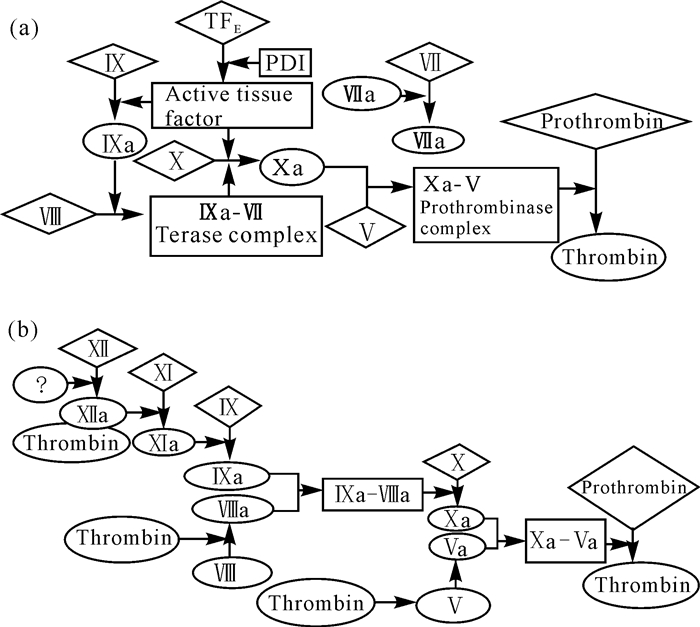
1.2 血栓形成机制正常状况下,人的血液具有流动性,不会凝固,这是由于血液中凝血因子与抗凝血因子相互制约达到平衡。血栓的形成是这种平衡被打破的结果,其成因为多种因素 (血液理化性质、血液成分、血管壁) 变化产生的结果[5]。凝血酶催化纤维蛋白原产生纤维蛋白多肽A及纤维蛋白多肽B,继而分解成纤维蛋白单体 (α、β、γ);单体自发聚合形成不稳定的纤维蛋白多聚体,在Ca2+、ⅩⅢ等因子存在下形成稳定的纤维蛋白多聚体,产生血栓的核心基质[6]。血栓的形成过程类似于凝血过程,具体如图 1所示[7]。
|
(a) 凝血酶的产生; (b) 级联放大:凝血酶的激增 (a) Initiation of thrombin production; (b) Amplification:Burst of thrombin production 图 1 凝血机制[7] Fig.1 Clotting mechanism[7] |
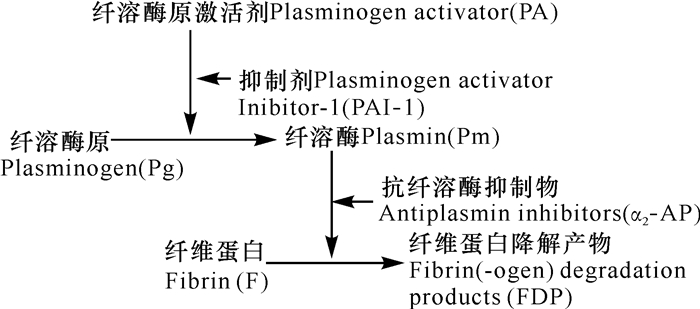
人体内溶栓机制依赖溶栓系统,即利用激活纤溶酶原 (Plasminogen, Pg) 形成纤溶酶 (Plasmin, Pm),降解纤维蛋白[8],溶栓酶的溶栓机制与体内溶栓机制相同。溶栓系统成分有组织型溶栓酶原激活剂 (t-PA)、单链尿激酶溶栓酶原激活剂 (Single chain urokinase type plasminogen, scu-PA)、Pg、Pm及溶栓抑制物 (α2-AP、羟脯氨酸糖蛋白等),具体调控过程如图 2所示[9]。
2 溶栓药物的发展溶栓药物因其溶栓快,副作用小而被广泛应用,成为血栓类疾病治疗的重要手段。其发展可分为三代[10-12]。溶栓药物主要依靠溶栓系统机制进行血栓的降解,传统溶栓药物主要依靠激活Pg产生Pm的通路进行血栓降解,新一代的溶栓药物则直接或间接作用于纤维蛋白。
2.1 第一代溶栓药物第一代溶栓药物主要依靠激活Pg产生Pm进行血栓降解,代表性药物有尿激酶 (Urokinase,UK) 和链激酶 (Steptokinase,SK)。两种溶栓药物虽然溶栓能力强,但在降解纤维蛋白时会一同降解纤维蛋白原,易导致全身纤溶亢进乃至引发出血等不良反应,安全性较差[13]。
2.2 第二代溶栓药物第二代溶栓药物有较好的纤维蛋白特异性,主要代表为t-PA、scu-PA及茴香酰纤溶酶原链激酶激活剂复合物 (Anisoylated plasminogen streptokinase activator complex, APSAC)[14]。t-PA是一种丝氨酸蛋白酶,scu-PA是UK无活性的前体,APSAC是UK和茴酰化的Pg产生的衍生物。相比于第一代溶栓药物,第二代溶栓药物有较高的纤维蛋白选择活性,其溶栓作用大于UK和SK[2],不良反应少。
2.3 第三代溶栓药物第三代溶栓药物是依靠基因工程等生物技术改造前两代溶栓药物,获得具有特异性、安全性、廉价等优点的突变体,代表药物有重组组织性溶栓酶原激活剂 (rt-PA)、兰替普酶[15]。第三代溶栓药物作用快速,特异性强,安全性高,是当前溶栓药物的主体。三代药物各有优势及不足,其对比见表 1。
| 表 1 三代溶栓药物对比 Table 1 Comparison of three generations thrombolytic drugs |
当今,进行临床治疗使用的药物大多为溶栓酶原激活剂类,但仍存在半衰期短、成本高等问题,因而科学家将目光投向新型天然溶栓药物的研究。天然溶栓药物来源于陆生微生物、植物、动物及海洋生物中。来源于微生物的溶栓酶有纳豆激酶 (Nattokinase, NK)[16]等;来源于陆生动物的溶栓酶有蛇毒酶类[17]、蚓激酶[18]、吸血蝙蝠唾液溶栓酶原激活剂[6];来源于海洋生物的溶栓酶有单环刺螠溶栓酶[19]、沙蚕溶栓酶[20]等。
3.1 纳豆激酶1987年,Sumi等[16]从纳豆中获得一株枯草芽胞杆菌,发现该菌株可产生一种具有溶栓活性的碱性丝氨酸蛋白酶,命名为纳豆激酶 (NK),其分子量为27.7 kDa,pI为8.6~8.9[21]。NK可以直接激活Pg产生Pm从而降解血栓,也可直接对纤维蛋白进行降解,是研究较早且较完善的天然溶栓酶。在研究NK溶栓机制的过程中,Zhang等[22]发现肝素可以影响体内丝氨酸蛋白酶的活性,而且体外实验证明NK可以与肝素相互作用,因此推测在血栓治疗过程中协同NK添加适量肝素有可能提高溶栓效果。同时Lampe等[23]对NK进行了安全评价,研究表明NK在体外是非致畸的,且以每天10 mg/kg的剂量,在4周内健康志愿者耐受良好,满足临床安全性使用要求。近年来也有研究发现NK不仅在溶栓过程起作用,还在治疗高血压中发挥重要作用。Jensen等[24]在NK进行的临床药效学研究中发现NK有明显缓解高血压症状的效果。
3.2 蚓激酶20世纪80年代,日本学者首先分离出有溶栓活性的蚓激酶 (LK)[18]。这类LK蛋白酶分子量为25~30 kDa,是一类丝氨酸蛋白酶,可以直接激活Pg产生Pm从而降解血栓,也可直接对纤维蛋白进行降解,还可以抑制凝血途径[18]。对于LK的安全性,Tjandrawinata等[25]对于蚓激酶DLBS 1033口服剂量进行了临床安全性评价,研究表明DLBS 1033以每日490 mg的剂量分3次给予,在健康成人中是安全的。这说明LK具有良好的生物安全性,值得深入研究开发。近年来,LK也被报道在心脏保护和神经再生方面起重要作用[26-27]。
3.3 吸血蝙蝠唾液溶栓酶原激活剂吸血蝙蝠唾液中含有两种与t-PA有较高同源性的蛋白质,即DSPAa1(43 kDa) 和DSPAa2(39 kDa)。研究表明,两种蛋白均具有优异的溶栓活性,其溶栓活性是t-PA的3.5倍,半衰期是t-PA的4倍,表明其具有较大的溶栓药物开发潜力[6]。2013年Ma等[28]在吸血蝙蝠唾液中鉴定到一种新型溶栓酶Desmolaris,在抗血栓形成中起重要作用,同时缓解多巴胺引起的血管通透性增加,是一种新颖的靶向FXIa的抗凝血剂。这说明这种溶栓酶在溶栓过程中有多个靶向位点,是十分有潜力的溶栓酶,值得深入开发。
3.4 来源于蛇毒的溶栓酶类蛇毒中含有多种溶栓酶。根据作用机制可分为类凝血酶、Pm和PA。蛇毒溶栓酶原激活剂 (TSV-PA) 是一种溶栓效率较高的溶栓酶,由于原料来源限制,多采用基因重组方法制备。曹郁等[17]将TSV-PA基因插入供体质粒pFastBacHTa中并在Tn-5B1-4细胞中表达,经过Western及酶活性检测表明,在昆虫细胞中表达的TSV-PA蛋白具有较高的活性,这为天然溶栓药物的制备提供了新来源。
3.5 单环刺螠溶栓酶蒋仲青等[19]在单环刺螠中提取出了单环刺螠溶栓酶 (UFEⅢ),其分子量约为26 kDa,最适反应pH值为8.0,具有优于蚓激酶的溶栓活性,是未来溶栓药物研究的又一热点。Bi等[29]对其溶栓效果进行了研究,实验结果表明UFEⅢ不引起机体溶血,无明显的出血反应,无明显急性毒性,具有直接降解纤维蛋白 (原) 和激活溶栓酶原的能力,在动物体内外都表现出了显著的抗凝、溶栓活性,有潜力成为一种新的溶栓制剂来源。
3.6 沙蚕溶栓酶近年,Zhang等[30]从潮间带多毛纲动物的沙蚕体内发现了新型溶栓酶,命名为N-V蛋白酶,是一种溶解纤维蛋白的丝氨酸蛋白酶。N-V蛋白酶是大小约为29 kDa的单链蛋白,其等电点为4.5。N-V蛋白酶水解纤维蛋白原的α链效率较高,水解β和γ链的效率较低 (α>β>γ)。
3.7 新型溶栓酶载体随着新型天然溶栓酶的不断发现,学者逐渐将寻找溶栓酶的方向从陆地动物转向海洋生物。天然溶栓酶溶栓效率高、安全性好,是未来溶栓药物研究的重点。除了天然溶栓酶,溶栓酶载体也是溶栓酶开发的方向。Marsh等[31]开发了一种新型的全氟化碳纳米粒子,该粒子具有纤维蛋白特异性,并且经过表面修饰后可以搭载链激酶。通过定量声学显微镜评估其体外靶向溶栓有效性,血浆凝块轮廓图检测显示,该全氟化碳纳米粒子可以快速诱导纤维蛋白溶解 ( < 60 min),且没有空化 (空载) 和微泡 (粒子自我聚集) 产生。说明这种基于纳米颗粒的新型溶栓酶复合物可以在体外特异性地快速溶解纤维蛋白,在急性缺血性中风的早期治疗中具有临床应用前景。这种载体搭载溶栓酶可高效定点治疗血栓,为溶栓酶的研究开辟了新的方向。
4 溶栓酶的制备 4.1 直接提取法直接提取法指的是从原材料 (陆生微生物、植物、动物及海洋生物) 中分离纯化出目的酶的方法。李岩[32]采用3 mmol/L CuSO4从人原尿液中沉淀出尿激酶,再使用氨水调节其pH值为9.0左右,以EDTA溶解沉淀,最后用体积分数为60%的乙醇分离纯化尿激酶,得到高纯度的尿激酶,回收率达90%以上。周海等[33]以赤子爱胜蚓 (Eisenia foelide) 为原料,经过匀浆抽提、硫酸铵分段盐析、色谱分离、电泳等技术对LK进行了分离纯化,最后得到LK样品比活力为5 100 U/mg,纯化倍数为1 408倍,得率为34.1%。
直接提取法操作简单,但原料的来源受环境等因素影响较大,不利于高质量样品的制备。所以,利用现代检测技术与分析手段对提取方法进行标准化是当前的重要研究内容。Fu等[34]运用两种方法 (日晒和冷冻干燥技术) 制备LK,发现不同方法制备的样品在活性方面具有差异。随后运用基于二维电泳的质谱技术,分析不同制备技术造成样品活性差异的原因,为直接提取法的规范化奠定了基础。
4.2 基因工程技术基因工程主要通过异源表达系统,对目标酶的基因序列进行克隆,进而转化到表达系统中重组表达。本文以t-PA和NK举例说明。
t-PA是最早应用基因重组技术进行表达的溶栓酶。Goojani等[35]基于根瘤农杆菌 (Agrobacterium tumefaciens) 转化系统将3个嵌合重组质粒pBI-SP-tPA、pBI-KDEL-tPA和pBI-Ext-tPA转化到烟草植物中 (3种质粒可以将t-PA分别定位到3个区域:SP-胞质空间,KDEL-内质网,Ext-载体空间的细胞区室),并使用Southern印迹分析来测定转化到每个转基因植物中的相应基因 (t-PA) 的拷贝数,结果检测到来自上述所有3种转化体的一个或多个拷贝,继而使其在宿主中表达,得到重组表达的rt-PA。这说明通过基因重组技术依靠烟草大规模生产纤溶酶t-PA是可行的。
Guan等[36]构建了霍乱毒素B亚基-蚓激酶 (CTB-LK) 融合基因,并转化到向日葵种子中表达。通过蛋白质印迹分析,纤维蛋白平板测定和GM1神经节苷脂证实,转基因向日葵种子中的重组蛋白存在溶栓活性。同时,血栓模型显示,口服具有CTB-LK表达的转基因向日葵种子具有显著的抗血栓作用。由于CTB-LK融合蛋白被设计用于口服给药,因此在可食用向日葵种子中CTB-LK的表达省去了对蛋白质的下游加工,更利于药物的生产。
在原核大肠杆菌表达过程中,常出现无活性包涵体。包涵体是肽链错误折叠形成的由膜包裹的高密度、不溶性蛋白质颗粒[37]。虽然包涵体没有活性,但可通过包涵体复性方法将其恢复结构从而得到有活性的蛋白。Xu等[38]和Li等[37]运用包涵体复性方法分别将蚓激酶PI239和CST1成功复性。其中,Xu等[38]构建了pET-22b (-) PI239重组基因并转化到BL21(DE3) 中诱导表达,对表达的包涵体经过S-300凝胶过滤纯化后,稀释复性得到有活性的PI239蛋白。复性成功后的PI239特异性活性可以达到1 600 IU/mg,回收率可达50%。纤维平板实验结果显示其与0.6 μg t-PA活性相等。包涵体复性的具体机理尚不明确,但由于其包涵体表达量高,复性成功后活性高,已成为溶栓酶生产方面的研究重点。
5 展望在血栓类疾病日益严重的今天,每年因血栓类疾病死亡的病人多达数百万,潜在的溶栓酶市场可达30多亿美元[39],所以溶栓酶的机理及应用研究显得十分重要。理想的溶栓酶应具有酶活力高、药效持续时间长、成本低、安全有效等优点。在自然界中寻找开发新型天然溶栓酶,同时借助现代结构生物学、酶工程等生物技术,阐明其机制及解决其制备的难点是将来的研究方向。另外,运用分子生物学技术,集合现有溶栓酶优点,设计出满足临床需求的溶栓酶是溶栓酶开发及基础研究的重点。
| [1] |
袁桂清. 血栓性疾病已成为威胁人类健康和生命的重要疾病[J]. 中华检验医学杂志, 2004, 27(8): 487. YUAN G Q. Thrombotic disease, the important diseases, has become a threat to human health and life[J]. Chinese Journal of Laboratory Medicine, 2004, 27(8): 487. |
| [2] |
奉涛. 溶栓药物的临床应用及其进展[J]. 临床合理用药, 2011, 4(6B): 145-146. FENG T. Clinical application and progress of thrombolytic drugs[J]. Chinese Journal of Clinical Rational Drug Use, 2011, 4(6B): 145-146. |
| [3] |
黄艳洪, 陈文阁. 血栓形成的危险因素[C]//2010年中国中西医结合周围血管疾病学术交流会论文集. 哈尔滨: 中国中西医结合学会, 2010. HUANG Y H, CHEN W G.Thrombosis risk factors[C]//Proceedings of the symposium on peripheral vascular diseases in Chinese journal of integrated traditional and western medicine.Harbin:China Society of Integrated Traditional Chinese and Western Medicine, 2010. |
| [4] |
TURITTO V T, WEISS H J. Red blood cells:Their dual role in thrombus formation[J]. Science, 1980, 207(4430): 541-543. DOI:10.1126/science.7352265 |
| [5] |
庞兴学, 王显. 血栓形成的过程与机制研究进展[J]. 医学综述, 2011, 17(11): 1613-1616. PANG X X, WANG X. Research progress in thrombosis and its mechanism[J]. Medical Recapitulate, 2011, 17(11): 1613-1616. |
| [6] |
许芳, 杨艳燕, 阎达中. 溶栓药物的研究进展及发展方向[J]. 现代商贸工业, 2003, 15(7): 45-47. XU F, YANG Y Y, YAN D Z. The advances in research of thrombolitics[J]. Modern Business Trade Industry, 2003, 15(7): 45-47. |
| [7] |
FURIE B, FURIE B C. Mechanisms of thrombus formation[J]. New England Journal of Medicine, 2008, 359(9): 938-949. DOI:10.1056/NEJMra0801082 |
| [8] |
蔡文文, 陈宏, 门剑龙. 系统性红斑狼疮患者凝血、纤溶系统与自身抗体及其血栓形成的关系[J]. 中国皮肤性病学杂志, 2013(3): 240-242. CAI W W, CHEN H, MEN J L. The research on association of coagulation, fibrinolyticsystem, autoantibodies and thrombosis in patients with systemic lupus erythematosus[J]. The Chinese Journal Dermatovenereology, 2013(3): 240-242. |
| [9] |
杜平中. 溶栓药物的研究进展[J]. 国外医药 (合成药·生化药·制剂分册), 1998, 19(2): 67-71. DU P Z. Research progress of thrombolytic drugs[J]. Foreign Medicine and Pharmacy, 1998, 19(2): 67-71. |
| [10] |
COLLEN D, LIJNEN H R. Tissue-type plasminogen activator:A historical perspective and personal account[J]. Journal of Thrombosis and Haemostasis, 2004, 2(4): 541-546. DOI:10.1111/jth.2004.2.issue-4 |
| [11] |
MACHRAOUI A, JÄGER D, BARMEYER J, et al. Efficacy and safety of APSAC in the treatment of acute myocardial infarction[J]. European Heart Journal, 1992, 13(6): 818-823. DOI:10.1093/oxfordjournals.eurheartj.a060263 |
| [12] |
WAN H, LIU Z, XIA X, et al. A recombinant antibody-targeted plasminogen activator with high affinity for activated platelets increases thrombolytic potency in vitro and in vivo[J]. Thrombosis Research, 2000, 97(3): 133-141. DOI:10.1016/S0049-3848(99)00142-5 |
| [13] |
RENATUS M, STUBBS M T, HUBER R, et al. Catalytic domain structure of vampire bat plasminogen activator:A molecular paradigm for proteolysis without activation cleavage[J]. Biochemistry, 1997, 436(44): 13483-13493. |
| [14] |
COLLEN D, LIJNEN H R. Thrombolytic agents[J]. Thromb Haemost, 2005, 93(4): 627-630. |
| [15] |
PERLER B. Thrombolytic therapies:The current state of affairs[J]. Journal of Endovascular Therapy, 2005, 12(2): 224-232. DOI:10.1583/04-1438.1 |
| [16] |
SUMI H, HAMADA H, TSUSHIMA H, et al. A novel fibrinolytic enzyme (nattokinase) in the vegetable cheese Natto; a typical and popular soybean food in the Japanese diet[J]. Experientia, 1987, 43(10): 1110-1111. DOI:10.1007/BF01956052 |
| [17] |
曹郁, 虞谷松, 杨胜利, 等. 蛇毒纤溶酶原激活剂TSV-PA在昆虫细胞中的表达[J]. 生物工程学报, 2001, 17(5): 506-509. CAO Y, YU G S, YANG S L, et al. Expression of a snake venom plasminogen activator TSV-PA in insect cells[J]. Chinese Journal of Biotechnology, 2001, 17(5): 506-509. |
| [18] |
MIHARA H, SUMI H, YONETA T, et al. A novel fibrinolytic enzyme extracted from the earthworm, Lumbricus rubellus[J]. The Japanese Journal of Physiology, 1991, 41(3): 461-472. DOI:10.2170/jjphysiol.41.461 |
| [19] |
蒋仲青, 刘万顺, 韩宝芹, 等. 单环刺螠纤溶酶的分离纯化及溶栓活性的初步研究[J]. 中国海洋大学学报:自然科学版, 2009, 39(S1): 138-142. JIANG Z Q, LIU W S, HAN B Q, et al. Purification and biological activity of fibrinolytic enzyme from urechis unicinctus[J]. Periodical of Ocean University of China, 2009, 39(S1): 138-142. |
| [20] |
CHANDRASEKARAN S D, VAITHILINGAM M, SHANKER R, et al. Exploring the in vitro thrombolytic activity of nattokinase from a new strain Pseudomonas aeruginosa CMSS[J]. Jundishapur Journal of Microbiology, 2015, 8(10): e23567. |
| [21] |
FUJITA M, NOMURA K, HONG K, et al. Purification and characterization of a strong fibrinolytic enzyme (nattokinase) in the vegetable cheese Natto, a popular soybean fermented food in Japan[J]. Biochemical and Biophysical Research Communications, 1993, 197(3): 1340-1347. DOI:10.1006/bbrc.1993.2624 |
| [22] |
ZHANG F M, ZHANG J H, LINHARDT R J. Interactions between nattokinase and heparin/GAGs[J]. Glycoconjugate Journal, 2015, 32(9): 695-702. DOI:10.1007/s10719-015-9620-8 |
| [23] |
LAMPE B J, ENGLISH J C. Toxicological assessment of nattokinase derived from Bacillus subtilisvar.natto[J]. Food and Chemical Toxicology, 2016, 88: 87-99. DOI:10.1016/j.fct.2015.12.025 |
| [24] |
JENSEN G S, LENNINGER M, ERO M P, et al. Consumption of nattokinase is associated with reduced blood pressure and von Willebrand factor, a cardiovascular risk marker:Results from a randomized, double-blind, placebo-controlled, multicenter North American clinical trial[J]. Integrated Blood Pressure Control, 2016, 9: 95-104. DOI:10.2147/IBPC |
| [25] |
TJANDRAWINATA R R, YUNAIDI D A, SUSANTO L W. The safety and tolerability of Lumbrokinase DLBS1033 in healthy adult subjects[J]. Drug Research, 2016, 66(6): 293-299. DOI:10.1055/s-00023610 |
| [26] |
LEE H C, HSU Y M, TSAI C C, et al. Improved peri-pheral nerve regeneration in streptozotocin-induced diabetic rats by oral lumbrokinase[J]. The American Journal of Chinese Medicine, 2015, 43(2): 215-230. DOI:10.1142/S0192415X15500147 |
| [27] |
LAI C H, HAN C K, SHIBU M A, et al. Lumbrokinase from earthworm extract ameliorates second-hand smoke-induced cardiac fibrosis[J]. Environmental Toxicology, 2015, 30(10): 1216-1225. DOI:10.1002/tox.v30.10 |
| [28] |
MA D Y, MIZURINI D M, ASSUMPÇĀO T C, et al. Desmolaris, a novel factor XIa anticoagulant from the salivary gland of the vampire bat (Desmodus rotundus) inhibits inflammation and thrombosis in vivo[J]. Blood, 2013, 122(25): 4094-4106. DOI:10.1182/blood-2013-08-517474 |
| [29] |
BI Q Q, CHU J X, FENG Y L, et al. Purification and characterization of a new serine protease with fibrinolytic activity from the marine invertebrate, Urechis unicinctus[J]. Applied Biochemistry and Biotechnology, 2013, 170(3): 525-540. DOI:10.1007/s12010-013-0168-4 |
| [30] |
ZHANG Y L, CUI J, ZHANG R, et al. A novel fibrinolytic serine protease from the polychaete Nereis (Neanthes) virens (Sars):Purification and characterization[J]. Biochimie, 2007, 89(1): 93-103. DOI:10.1016/j.biochi.2006.07.023 |
| [31] |
MARSH J N, SENPAN A, HU G, et al. Fibrin-targeted perfluorocarbon nanoparticles for targeted thrombolysis[J]. Nanomedicine, 2007, 2(4): 533-543. DOI:10.2217/17435889.2.4.533 |
| [32] |
李岩. 从人尿中提取尿激酶的新方法[J]. 食品与发酵科技, 2013, 49(3): 43-45. LI Y. A new method of extract urokinase from human urine[J]. Food and Fermentation Technology, 2013, 49(3): 43-45. |
| [33] |
周海, 王春维, 张怡, 等. 蚓激酶的提取纯化及性质研究[J]. 中国生化药物杂志, 2011, 32(3): 212-216. ZHOU H, WANG C W, ZHANG Y, et al. Purification and characterization of lumbrokinas[J]. Chinese Journal of Biochemical Pharmaceutics, 2011, 32(3): 212-216. |
| [34] |
FU Z R, ZHANG L, LIU X B, et al. Comparative proteomic analysis of the sun-and freeze-dried earthworm Eisenia fetida with differentially thrombolytic activities[J]. Journal of Proteomics, 2013, 83: 1-14. DOI:10.1016/j.jprot.2013.02.028 |
| [35] |
GOOJANI H G, JAVARAN M J, NASIRI J, et al. Expression and large-scale production of human tissue plasminogen activator (t-PA) in transgenic tobacco plants using different signal peptides[J]. Applied Biochemistry and Biotechnology, 2013, 169(6): 1940-1951. DOI:10.1007/s12010-013-0115-4 |
| [36] |
GUAN C F, JING J, CHAO J, et al. Expression of cho-lera toxin B subunit-lumbrokinase in edible sunflower seeds-the use of transmucosal carrier to enhance its fusion protein's effect on protection of rats and mice against thrombosis[J]. Biotechnology Progress, 2014, 30(5): 1029-1039. DOI:10.1002/btpr.1963 |
| [37] |
LI G Q, WANG K Y, LI D H, et al. Cloning, expression and characterization of a gene from earthworm Eisenia fetida encoding a blood-clot dissolving protein[J]. PLoS One, 2012, 7(12): e53110. DOI:10.1371/journal.pone.0053110 |
| [38] |
XU Z R, YANG Y M, GUI Q F, et al. Expression, purification, and characterization of recombinant lumbrokinase PI239 in Escherichia coli[J]. Protein Expression & Purification, 2010, 69(2): 198-203. |
| [39] |
汪世华, 胡开辉, 沙莉, 等. 溶栓酶的研究与开发[J]. 现代食品科技, 2006, 22(1): 174-176. WANG S H, HU K H, SHA L, et al. Progress in research of the fibrinolytic enzyme[J]. Modern Food Science and Technology, 2006, 22(1): 174-176. |
 2017, Vol. 24
2017, Vol. 24