烟曲霉 (Aspergillus fumigatus) 是一种常见的丝状真菌,同时也是三大机会致病真菌之一。其感染途径主要是通过呼吸道,偶见皮肤、腹膜、肾、骨、眼睛及消化道感染的报道[1-3]。与其他曲霉相比,烟曲霉易于在广泛的环境条件下生存和繁殖;孢子较其他真菌更易在空气中扩散;容易在人体呼吸道内定殖和生存;孢子可以在免疫缺陷宿主环境中快速萌发及适应等特点都是烟曲霉的优势[4]。临床上最常见的烟曲霉感染主要有3种:变态反应性支气管曲霉病 (Allegic Bronchopulmonary Aspergillosis, ABPA)[5]、曲霉瘤 (Aspergilloma) 和侵袭性曲霉病 (Invasive Aspergillosis,IA)[6]。据统计全球每年约有20万人感染侵袭性曲霉病,其致死率为30%~95%[7]。
近年来由于免疫缺陷 (如艾滋病人)、免疫系统受到抑制 (如骨髓移植患者) 和进行放化疗癌症患者的人数增加,侵袭性真菌感染已经是全球不容忽视的疾病。而这些隐形的真菌杀手难以控制的主要原因在于:(1) 早期难以精确快速诊断,(2) 有限的抗真菌药物,(3) 愈来愈多的抗药性真菌菌株出现。目前有3类抗真菌药用于临床治疗,分别为多烯类Polyenes,唑类Azoles和棘白菌素类Echinocandins。然而考虑到药物有效性、毒性、相互作用等,这些药物都有一定的缺陷,尤其是近年来对唑类和棘白菌素类呈耐药性的菌株越来越多,因此寻找新的药物靶标和开发新型抗真菌药物已经迫在眉睫。
真菌细胞壁是一个高度动态的多层次结构,担当着维持细胞形状及结构完整性,保护真菌抵抗外界压力和感染时首先与宿主免疫系统作战等功能。与哺乳动物相比细胞壁的结构和合成是真菌所特有的,因此长期以来真菌细胞壁都被当作理想的药物靶标。真菌细胞壁主要由糖蛋白和多糖组成,其中多糖含量达90%以上,包括几丁质和β-葡聚糖两种主要组分。葡聚糖是由线性β/α-1, 3-连接的葡萄糖长链组成,有些真菌中也含有β-1, 6-葡聚糖。几丁质是由β-1, 4-连接的N-乙酰葡萄糖胺线性聚合而成。细胞壁组分会随着细胞生长阶段和生长条件而变化,而糖蛋白、葡聚糖和几丁质交联在一起组成一个复杂的网状结构是细胞壁的结构基础。细胞壁的合成与重建需要多个生物合成途径及数以百计的基因产品来调控和参与,其中直接参与细胞壁各组分合成的酶都被列为潜在的药靶。
与其他丝状真菌和酵母相比,烟曲霉细胞壁既有相同的特征也有特有的特征,同时在不同的生理形态期 (如孢子和菌丝生长期) 细胞壁的组分也有典型的区别。烟曲霉细胞壁约占细胞干重的30%,其中90%的细胞壁由多糖组成并与糖蛋白交联或者被覆盖。多糖组分中20%~35%是β-1, 3-葡聚糖,35%~46%是α-1, 3-葡聚糖,20%~25%是半乳甘露聚糖 (Galactomannan),7%~15%是几丁质[8]。葡聚糖、几丁质及半乳甘露聚糖等多糖的合成分别起始于细胞内的核苷酸糖如UDP-葡萄糖 (UDP-Glc),UDP-N-乙酰葡萄糖胺 (UDP-GlcNAc) 及GDP-甘露糖 (GDP-Man)(图 1)。本文将分析烟曲霉细胞壁各个组分的合成途径并探讨参与合成的相关酶作为新的药物靶标的前景。
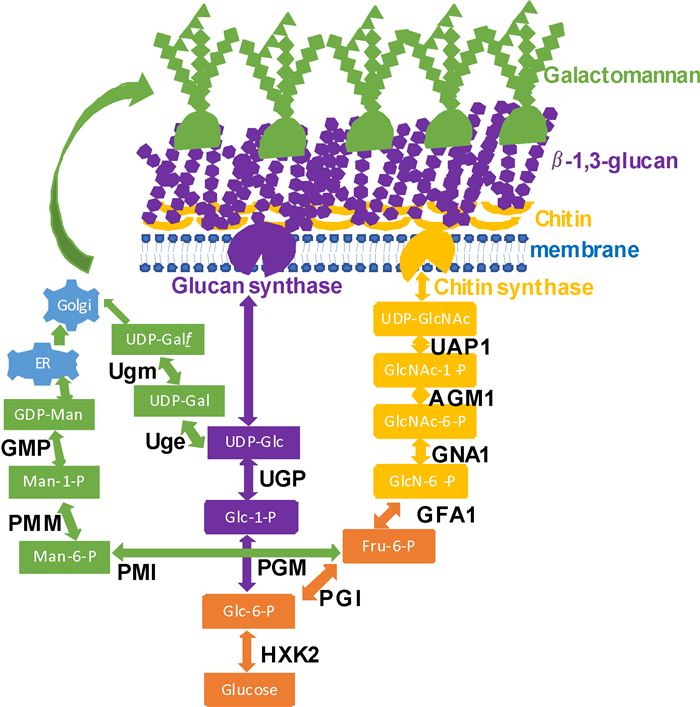
|
图 1 核苷酸糖前体及真菌细胞壁合成概述 Fig.1 A schematic overview of the sugar nucleotide precursors and fungal cell wall biosynthesis |
葡聚糖的合成从葡萄糖的活化形式UDP-Glc开始 (图 1)。β-1, 3-葡聚糖的合成由一个大的蛋白复合体 (包括催化亚基Fks1和调控亚基AfRho1) 完成[9]。Fks1已经在很多真菌中被鉴定和分析,是一个多次跨膜的大蛋白分子,对烟曲霉的生长和生存是必需的[10-11]。同时化学手段也验证了Fks1是棘白菌素类药物的靶标。然而在体外表达如此大的膜蛋白的不可实现性和棘白菌素类药物作用机理尚不明了,极大地限制了将Fks1作为药靶的后续开发。但是,研究发现Fks1的活性由AfRho1严格调控[12]。AfRho1是烟曲霉Rho GTPase家族的一员,也是烟曲霉生存的必需蛋白[13]。虽然与烟曲霉Rho GTPase家族其他成员和人同源蛋白有高度保守性,但通过基于片段分子的药物发现 (fragment-based drug discovery) 方法是有可能得到只特定抑制AfRho1而不抑制其他Rho GTPase蛋白的先导化合物的。
烟曲霉α-1, 3-葡聚糖的合成由3个基因AGS1, AGS2和AGS3编码的α-1, 3-葡聚糖合成酶完成。3个基因都敲除后的菌株尽管细胞壁完全缺失α-1, 3-葡聚糖组分但不影响细胞的生长和萌发。而突变株由于孢子细胞壁表面结构发生变化,导致其在曲霉感染小鼠模型中毒力明显下降[14],说明α-1, 3-葡聚糖合成酶对烟曲霉的感染很重要。目前还没有对这3个膜蛋白的生化与结构的相关研究,这使得把它们作为药靶的研究无法深入开展。
近年来由于基于片段分子的药物发现方法的兴起和发展,人们将注意力转移到了虽然有人的同源蛋白但具有可体外表达、测活性、结晶、解析结构并获得与小分子化合物形成复合物等特性的酶上。因此参与合成葡聚糖合成前体UDP-Glc的酶也被列为潜在药靶。UDP-Glc在细胞内的合成起始于葡萄糖,在己糖激酶2(HXK2) 的作用下先被磷酸化为葡萄糖-6-磷酸 (Glc-6-P),之后被磷酸葡萄糖变位酶 (PGM) 转变成葡萄糖-1-磷酸 (Glc-1-P),最后在UDP-Glc焦磷酸化酶 (UGP) 的作用下转化成前体UDP-Glc (图 1)。HXK2、PGM及UGP都已被列为潜在的药靶,它们对烟曲霉的重要性及与片段分子结合的研究正在开展中。
2 参与几丁质合成的酶作为药靶的鉴定研究烟曲霉几丁质的合成是以活化的UDP-GlcNAc为底物,由几丁质合成酶家族在细胞壁空间组装[15](图 1)。这个家族包括8个跨膜蛋白,基于氨基酸序列被归为两个亚家族,CHSA-C和CHSG属于亚家族一,CHSF、CHSD、CSMA和CSMB属于亚家族二。几丁质合成酶亚家族内单个及多个基因的敲除及表型分析表明:亚家族一的全部基因被敲除后对几丁质的合成几乎没有影响,但菌株生长减慢、合成酶活性降低、产孢能力下降及菌丝形态有所变化[16];亚家族二的成员被敲除后也不影响细胞壁几丁质的含量,但是细胞壁结构被重排并伴随着菌丝形态发生重大变化及小鼠感染模型中毒力降低[16]。很显然,整个几丁质合成酶家族共同负责几丁质的合成从而赋予细胞刚性。但是介于冗余性和跨膜大蛋白分子的特性,以单个几丁质合成酶作为药靶的可能性很低,除非设计并合成基于作用机理的抑制剂,因为所有的几丁质合成酶都包括QRRRW催化结构域。
与UDP-Glc的合成相似,参与合成几丁质合成前体UDP-GlcNAc的酶也被列为药靶。以果糖-6-磷酸 (Fru-6-P) 为起始底物,在真核细胞内有4个酶参与了UDP-GlcNAc的合成[17](图 1)。首先是葡萄糖胺-6-磷酸 (GlcN-6-P) 合成酶 (GFA1) 将谷氨酰胺的一个氨基转移到Fru-6-P并将其产物异构成GlcN-6-P。这一步是整个UDP-GlcNAc合成途径的限速步骤。GFA1已经在烟曲霉中被证实为必需基因[18],其抑制剂已有报道[19]。第2个酶是GlcN-6-P乙酰转移酶 (GNA1), 可以将GlcN-6-P转变成N-乙酰葡萄糖胺-6-磷酸 (GlcNAc-6-P)。烟曲霉GNA1的三维结构已经被解析[20],缺失时烟曲霉不能存活,除非在培养基中补充N-乙酰葡萄糖胺 (GlcNAc) 才能生长[21]。更为鼓舞人心的是,最近我们筛选出的片段分子选择性地只结合在烟曲霉二聚体的交界面,而不与人的GNA1结合[22],片段分子的进一步优化正在进行中。第3个酶是磷酸乙酰葡萄糖胺变位酶 (AGM1),可以催化可逆的GlcNAc-6-P到N-乙酰葡萄糖胺-1-磷酸 (GlcNAc-1-P) 的反应。最近研究表明AGM1也是烟曲霉的必需基因,它对细胞壁的合成至关重要,同时解析的三维结构与人的AGM1相比,在活性位点区不同[22],预示着用片段分子库筛选的方法有可能得到特异的烟曲霉AGM1的抑制剂。最后一步的催化酶是UDP-GlcNAc焦磷酸化酶 (UAP1),可以将GlcNAc-1-P与UTP催化成终产物UDP-GlcNAc。最近研究也表明UAP1是烟曲霉生存所必需,下调其表达影响了细胞的形态发生、细胞壁完整性及结构[23]。与人的UAP1结构相比,烟曲霉UAP1在活性位点区有所不同,不仅如此,开发UAP1的变构抑制剂也有极大可能,因为相关研究已经在布氏锥虫Trypanosoma brucei中进行[24]。
3 参与半乳甘露聚糖合成的酶作为药靶的鉴定研究半乳甘露聚糖是由α-连接的甘露聚糖主干与分支的几个β-连接的呋喃半乳糖 (galactofuranose, Galf) 组成的多糖组分。葡聚糖和几丁质的合成都是由膜蛋白合成酶在细胞外合成与装配的,而半乳甘露聚糖的合成是在胞内细胞器完成再转运到细胞壁的 (图 1)。甘露聚糖的合成前体是GDP-Man,由Glc-6-P在磷酸葡萄糖异构酶 (phosphoglucoisomerase, PGI) 作用下转变为Fru-6-P,再由磷酸甘露糖异构酶 (phosphomanose isomerase, PMI)、磷酸甘露糖变位酶 (phosphomanose mutase, PMM) 及GDP-Man焦磷酸化酶 (GDP-manose pyrophosphorylase, GMP) 催化依次生成甘露糖-6-磷酸 (Man-6-P),甘露糖-1-磷酸 (Man-1-P) 及GDP-Man。研究表明PMI和GMP是烟曲霉的必需蛋白,对细胞壁的合成至关重要[25-26],筛选并设计真菌特异性抑制剂的工作目前正在进行中。而对PGI及PMM尚无研究,首先需要利用遗传学手段验证其功能的重要性。
呋喃半乳糖 (Galf) 的合成 (图 1) 是由UDP-Glc在UDP-半乳糖-4-差向异构酶 (UDP-galactose-4-epimerase, Uge) 及UDP-半乳糖变位酶 (UDP-galactose mutase, Ugm) 的作用下转变为UDP-Galf,之后被转运到高尔基体合成Galf糖链[27],同时在高尔基体内Galf糖链与甘露糖链连接形成半乳甘露聚糖,最终转运到细胞壁。目前对Uge和Ugm的研究表明它们并非烟曲霉的必需基因[27],半乳甘露聚糖及呋喃半乳糖对烟曲霉毒力的影响也有争议[28-29],因此限制了这些酶作为潜在药靶的可能性。
4 其他参与细胞壁组装与修饰的酶作为药靶的鉴定研究以上新合成的各个多糖组分在细胞壁空间还要被一系列糖基水解酶和糖基转移酶修饰,如葡聚糖的延长、分支、水解,几丁质的水解以及不同多糖之间的交联等,最终会形成三维网络状的坚固细胞壁。β-1, 3-葡聚糖的延长是由以GPI形式锚定在膜上的Gel糖蛋白家族完成的。烟曲霉有7个此家族成员,其中只有Gel4是必需基因[30],并且其酿酒酵母同源蛋白的结构已知[31],因此Gel4是一个值得探索的药靶。β-1, 3-葡聚糖的分支由BGT1基因介导,然而该基因的敲除株没有任何表型[32],说明它在细胞壁组装中没有发挥重要作用。β-1, 3-葡聚糖及α-1, 3-葡聚糖的水解都是由多个内切和外切的葡聚糖酶共同完成的[8],目前对少数几个基因的功能分析尚未显示它们的重要性,而且由于多基因的冗余性使得将它们作为药靶的可能性降低。几丁质酶负责几丁质的水解。烟曲霉有5个植物型、12个细菌型几丁质酶[33],敲除所有植物型或单个细菌型几丁质酶对烟曲霉的生存和毒力基本没有影响[34-35],因此虽然针对真菌几丁质酶的抑制剂很多[36],但目前没有且很难开发能完全抑制烟曲霉几丁质酶的抑制剂。细胞壁多糖组分之间的交联被认为是细胞壁合成的最后一步。迄今研究最多的是酿酒酵母中几丁质与葡聚糖的交联酶,这类酶首先是发挥几丁质酶的作用将几丁质切开,然后利用糖基转移酶功能将几丁质还原端连接到葡聚糖的非还原端[37]。烟曲霉含有5个这样的交联酶[38],对它们的功能、活性、结构及能否作为药靶正在研究中。
5 展望细胞壁是复杂而且高度动态的结构,它的合成是由多个合成途径多个基因共同参与的结果。本文只是简单列出了这个复杂生物过程的概况,其中一些参与烟曲霉细胞壁合成的酶可以作为药物靶标做进一步的研究 (表 1), 但是许多细胞壁合成酶显然不适合作为药物靶标。今后需要进一步对参与调控细胞壁动态合成以及对不同环境作出感应的酶或者转录因子进行功能分析,并选出可以开发为新药靶的候选者,同时引入基于片段分子的药物筛选等新技术,将有助于快速地鉴定烟曲霉药靶的成药性 (Druggability) 及可开发性。
| 表 1 烟曲霉细胞壁药靶的遗传鉴定、特征及目前药物开发进展 Table 1 The genetic validation, features and current progress on A.fumigatus cell wall targets |
| [1] |
KNUTSEN A P, SLAVIN R G. Allergic bronchopulmonary aspergillosis in patients with cystic fibrosis[J]. Clin Rev Allergy, 1991, 9(1/2): 103-118. |
| [2] |
PRESCOTT R J, HARRIS M, BANERJEE S S. Fungal infections of the small and large intestine[J]. J Clin Pathol, 1992, 45(9): 806-811. DOI:10.1136/jcp.45.9.806 |
| [3] |
欧阳浩淼, 金城. 烟曲霉细胞壁及其GPI锚定结构研究进展[J]. 广西科学, 2014, 22(2): 99-102. OUYANG H M, JIN C. Cell wall and GPI structure in Aspergillus fumigatus[J]. Guangxi Sciences, 2014, 22(2): 99-102. |
| [4] |
KWON-CHUNG K J, SUGUI J A. Aspergillus fumig-atus—what makes the species a ubiquitous human fungal pathogen?[J]. PLoS Pathog, 2013, 9(12): e1003743. DOI:10.1371/journal.ppat.1003743 |
| [5] |
BASICH J E, GRAVES T S, BAZ M N, et al. Allergic bronchopulmonary aspergillosis in corticosteroid-dependent asthmatics[J]. J Allergy Clin Immunol, 1981, 68(2): 98-102. DOI:10.1016/0091-6749(81)90165-2 |
| [6] |
ELLIS M. Therapy of Aspergillus fumigatus-related diseases[J]. Contrib Microbiol, 1999, 2: 105-129. DOI:10.1159/000060306 |
| [7] |
BROWN G D, DENNING D W, GOW N A, et al. Hidden killers:Human fungal infections[J]. Sci Transl Med, 2012, 4(165): 165rv13. |
| [8] |
GASTEBOIS A, CLAVAUD C, AIMANIANDA V, et al. Aspergillus fumigatus:Cell wall polysaccharides, their biosynthesis and organization[J]. Future Microbiol, 2009, 4(5): 583-595. DOI:10.2217/fmb.09.29 |
| [9] |
DOUGLAS C M. Fungal β(1, 3)-D-glucan synthesis[J]. Med Mycol, 2001, 39(S1): 55-66. |
| [10] |
DICHTL K, SAMANTARAY S, AIMANIANDA V, et al. Aspergillus fumigatus devoid of cell wall β-1, 3-glucan is viable, massively sheds galactomannan and is killed by septum formation inhibitors[J]. Mol Microbiol, 2015, 95(3): 458-471. DOI:10.1111/mmi.2015.95.issue-3 |
| [11] |
FIRON A, BEAUVAIS A, LATGÉ J P, et al. Characterization of essential genes by parasexual genetics in the human fungal pathogen Aspergillus fumigatus:Impact of genomic rearrangements associated with electroporation of DNA[J]. Genetics, 2002, 161(3): 1077-1087. |
| [12] |
QADOTA H, PYTHON C P, INOUE S B, et al. Identification of yeast Rho1p GTPase as a regulatory subunit of 1, 3-β-glucan synthase[J]. Science, 1996, 272(5259): 279-281. DOI:10.1126/science.272.5259.279 |
| [13] |
DICHTL K, HELMSCHROTT C, DIRR F, et al. Deciphering cell wall integrity signalling in Aspergillus fumigatus:Identification and functional characterization of cell wall stress sensors and relevant Rho GTPases[J]. Mol Microbiol, 2012, 83(3): 506-519. DOI:10.1111/mmi.2012.83.issue-3 |
| [14] |
BEAUVAIS A, BOZZA S, KNIEMEYER O, et al. Deletion of the α-(1, 3)-glucan synthase genes induces a restructuring of the conidial cell wall responsible for the avirulence of Aspergillus fumigatus[J]. PLoS Pathog, 2013, 9(11): e1003716. DOI:10.1371/journal.ppat.1003716 |
| [15] |
RONCERO C. The genetic complexity of chitin synthesis in fungi[J]. Curr Genet, 2002, 41(6): 367-378. DOI:10.1007/s00294-002-0318-7 |
| [16] |
MUSZKIETA L, AIMANIANDA V, MELLADO E, et al. Deciphering the role of the chitin synthase families 1 and 2 in the in vivo and in vitro growth of Aspergillus fumigatus by multiple gene targeting deletion[J]. Cell Microbiol, 2014, 16(12): 1784-1805. DOI:10.1111/cmi.2014.16.issue-12 |
| [17] |
MILEWSKI S, GABRIEL I, OLCHOWY J. Enzymes of UDP-GlcNAc biosynthesis in yeast[J]. Yeast, 2006, 23(1): 1-14. DOI:10.1002/(ISSN)1097-0061 |
| [18] |
HU W Q, SILLAOTS S, LEMIEUX S, et al. Essential gene identification and drug target prioritization in Aspergillus fumigatus[J]. PLoS Pathog, 2007, 3(3): e24. DOI:10.1371/journal.ppat.0030024 |
| [19] |
DURAND P, GOLINELLI-PIMPANEAU B, MOUILLERON S, et al. Highlights of glucosamine-6P synthase catalysis[J]. Arch Biochem Biophys, 2008, 474(2): 302-317. DOI:10.1016/j.abb.2008.01.026 |
| [20] |
HURTADO-GUERRERO R, RAIMI O G, MIN J R, et al. Structural and kinetic differences between human and Aspergillus fumigatus D-glucosamine-6-phosphate N-acetyltransferase[J]. Biochem J, 2008, 415(2): 217-223. DOI:10.1042/BJ20081000 |
| [21] |
LOCKHART D E A, ROBINSON D A, FANG W X, et al. Validation of Aspergillus fumigatus glucosamine-6-phosphate N-acetyltransferase as a potential antifungal target[J]. The Lancet, 2014, 383(S1): S69. |
| [22] |
FANG W X, DU T, RAIMI O G, et al. Genetic and structural validation of Aspergillus fumigatus N-acetylphosphoglucosamine mutase as an antifungal target[J]. Biosci Rep, 2013, 33(5): e00063. |
| [23] |
FANG W X, DU T, RAIMI O G, et al. Genetic and structural validation of Aspergillus fumigatus UDP-N-acetylglucosamine pyrophosphorylase as an antifungal target[J]. Mol Microbiol, 2013, 89(3): 479-493. DOI:10.1111/mmi.2013.89.issue-3 |
| [24] |
URBANIAK M D, COLLIE I T, FANG W X, et al. A novel allosteric inhibitor of the uridine diphosphate N-acetylglucosamine pyrophosphorylase from Trypanosoma brucei[J]. ACS Chem Biol, 2013, 8(9): 1981-1987. DOI:10.1021/cb400411x |
| [25] |
FANG W X, YU X Y, WANG B, et al. Characterization of the Aspergillus fumigatus phosphomannose isomerase Pmi1 and its impact on cell wall synthesis and morphogenesis[J]. Microbiology, 2009, 155(10): 3281-3293. DOI:10.1099/mic.0.029975-0 |
| [26] |
JIANG H C, OUYANG H M, ZHOU H, et al. GDP-mannose pyrophosphorylase is essential for cell wall integrity, morphogenesis and viability ofAspergillus fumigatus[J]. Microbiology, 2008, 154(9): 2730-2739. DOI:10.1099/mic.0.2008/019240-0 |
| [27] |
LEE M J, GRAVELAT F N, CERONE R P, et al. Overlapping and distinct roles of Aspergillus fumigatus UDP-glucose 4-epimerases in galactose metabolism and the synthesis of galactose-containing cell wall polysaccharides[J]. J Biol Chem, 2014, 289(3): 1243-1256. DOI:10.1074/jbc.M113.522516 |
| [28] |
LAMARRE C, BEAU R, BALLOY V, et al. Galactofuranose attenuates cellular adhesion of Aspergillus fumigatus[J]. Cell Microbiol, 2009, 11(11): 1612-1623. DOI:10.1111/cmi.2009.11.issue-11 |
| [29] |
SCHMALHORST P S, KRAPPMANN S, VERVECK-EN W, et al. Contribution of galactofuranose to the virulence of the opportunistic pathogen Aspergillus fumigatus[J]. Eukaryot Cell, 2008, 7(8): 1268-1277. DOI:10.1128/EC.00109-08 |
| [30] |
GASTEBOIS A, FONTAINE T, LATGÉ J P, et al. β(1-3) Glucanosyltransferase Gel4p is essential for Aspergillus fumigatus[J]. Eukaryotic Cell, 2010, 9(8): 1294-1298. DOI:10.1128/EC.00107-10 |
| [31] |
HURTADO-GUERRERO R, SCHVTTELKOPF A W, MOUYNA I, et al. Molecular mechanisms of yeast cell wall glucan remodeling[J]. Journal of Biological Chemistry, 2009, 284(13): 8461-8469. DOI:10.1074/jbc.M807990200 |
| [32] |
MOUYNA I, HARTLAND R P, FONTAINE T, et al. A 1, 3-βglucanosyltransferase isolated from the cell wall of Aspergillus fumigatusis a homologue of the yeast Bgl2p[J]. Microbiology, 1998, 144(11): 3171-3180. DOI:10.1099/00221287-144-11-3171 |
| [33] |
TAIB M, PINNEY J W, WESTHEAD D R, et al. Differential expression and extent of fungal/plant and fungal/bacterial chitinases of Aspergillus fumigatus[J]. Arch Microbiol, 2005, 184(1): 78-81. DOI:10.1007/s00203-005-0028-x |
| [34] |
ALCAZAR-FUOLI L, CLAVAUD C, LAMARRE C, et al. Functional analysis of the fungal/plant class chitinase family in Aspergillus fumigatus[J]. Fungal Genet Biol, 2011, 48(4): 418-429. DOI:10.1016/j.fgb.2010.12.007 |
| [35] |
JAQUES A K, FUKAMIZO T, HALL D, et al. Disruption of the gene encoding the ChiB1 chitinase of Aspergillus fumigatus and characterization of a recombinant gene product[J]. Microbiology, 2003, 149(10): 2931-2939. DOI:10.1099/mic.0.26476-0 |
| [36] |
LOCKHART D E A, SCHUETTELKOPF A, BLAIR D E, et al. Screening-based discovery of Aspergillus fumigatus plant-type chitinase inhibitors[J]. FEBS Lett, 2014, 588(17): 3282-3290. DOI:10.1016/j.febslet.2014.07.015 |
| [37] |
CABIB E, BLANCO N, GRAU C, et al. Crh1p and Crh2p are required for the cross-linking of chitin to β(1-6) glucan in the Saccharomyces cerevisiae cell wall[J]. Mol Microbiol, 2007, 63(3): 921-935. |
| [38] |
ARROYO J, FARKAŠ V, SANZ A B, et al. Strengthening the fungal cell wall through chitin-glucan cross-links:Effects on morphogenesis and cell integrity[J]. Cell Microbiol, 2016, 18(9): 1239-1250. DOI:10.1111/cmi.v18.9 |
 2017, Vol. 24
2017, Vol. 24 

