2. 北京师范大学环境学院,水沙科学教育部重点实验室,北京 100875
2. Key Laboratory of Water and Sediment Sciences, School of Environment, Beijing Normal University, Beijing, 100875, China
【研究意义】毒死蜱(chlorpyrifos)是一种广谱性有机磷酸酯类杀虫剂,是全球生产和销售最大的农用杀虫剂品种之一。2002年至2006年全球毒死蜱施用量为2.5万t (以有效成分含量计)[1],中国是毒死蜱需求量最大的国家之一。农业上过度施用的毒死蜱,有80%的量均进入到土壤中;在强降雨或灌溉条件下,毒死蜱易随降雨与灌溉水下渗到地下水中,致使许多地区地下水均已经受到毒死蜱的污染[1-2]。长期或反复接触毒死蜱可引起人的中枢神经系统紊乱,甚至可能引发癌症[3];另外,毒死蜱对许多水生生物也存在较强的毒性作用[3-5]。地下水是我国大部分农村地区主要的饮用水源之一,一旦其被毒死蜱污染,人们的健康将受到严重威胁。因此农业区毒死蜱在土壤包气带中的迁移、毒死蜱对地下水污染的状况以及其对地下水污染的风险评估受到越来越多研究者的关注。【前人研究进展】毒死蜱向地下水的迁移能力主要取决于土壤对毒死蜱的吸附能力,而毒死蜱的吸附能力主要通过吸附特征参数表征。因此,吸附特征参数常作为重要评价指标用于农药污染地下水风险评价中(如AF参数法和GUS值法)。土壤理化性质如土壤矿物特性、土壤有机质含量及土壤pH值等,是影响土壤吸附毒死蜱能力的关键因素[6-10]:孙扬等[10]研究指出土壤有机质含量和粘粒含量在毒死蜱吸附过程中起着决定性作用;朱丽珺等[7]研究表明pH值对腐殖质和膨润土吸附毒死蜱影响,且pH=6.0时吸附最佳。【本研究切入点】土壤理化性质会因耕作类型和土壤深度而发生改变,但目前的研究大多集中在农药与表层土壤的吸附及其影响因素方面,地下水风险评价中大多也只考虑表层土对农药的吸附能力。掌握不同深度的土壤对毒死蜱的吸附特征以及土壤理化性质与吸附毒死蜱的程度关系,对全面准确地评价毒死蜱在土壤中的迁移能力及其对地下水污染风险至关重要。【拟解决的关键问题】研究不同类型农业活动区剖面土壤对毒死蜱的吸附特征,探究导致毒死蜱在土壤中迁移能力不同的主要原因;同时考察土壤理化性质随耕作类型和土壤深度的变化情况,并探明不同土壤理化性质对土壤吸附毒死蜱的影响程度,筛选出影响吸附的主要理化性质参数; 从而进一步利用这些理化性质参数表示土壤吸附毒死蜱的特征参数,为毒死蜱污染地下水风险中相关指标值的获得提供简单可靠的方法。
1 材料与方法 1.1 材料供试土壤:按土壤表观色泽分3层采集常州武进水稻土和天津西青区蔬菜种植区土壤;在山东寿光罗家庄蔬菜种植基地每隔20 cm采集共5层剖面土壤,采样深度约1.1 m。土壤采集后自然风干,分别过2 mm筛和100目筛,每层充分混合,装袋备用。
供试农药:毒死蜱原药由上海安谱科学仪器有限公司提供,纯度为98.6%。
毒死蜱水溶液:配置含有0.005 mol·L-1的氯化钙和100 mg·L-1叠氮化钠的背景溶液,在1 L的背景溶液中加入一定体积的溶于甲醇的毒死蜱溶液(1 g·L-1),保证加入甲醇的体积小于0.1%,然后混合超声1 h,在摇床上常温振荡12 h后用0.45 μm玻璃纤维膜过滤,将滤液装入棕色瓶内4℃保存待用。
1.2 方法 1.2.1 土壤理化性质测定土壤pH值采用pH电极直接测定。土壤阳离子交换量(CEC)采用NH4Cl-NH4OAc法测定。土壤经稀盐酸酸化处理冷冻干燥后,用Vario EI型元素分析仪测定总有机质含量。土壤样品经HF-HClO4-HCl消解后,采用电感耦合等离子体光谱仪(ICP)测定矿物含量(Fe、Al、Ca、Mg和Mn)。根据土壤pH值添加六偏磷酸钠或氢氧化钠溶液作为分散剂,与2 mm过筛土壤(固液比为1:2.5)混溶,振荡2 h,然后超声30 min,用激光粒度仪S3500测定土壤机械组成。
1.2.2 吸附实验吸附动力学实验:准确称取1.00 g土样于40 mL样品瓶内,称(40.00±0.5) g毒死蜱水溶液于瓶内,用内衬聚四氟乙烯垫子的盖子旋紧密封好,放入25℃,120 r·min-1的摇床内振荡,并立刻计时。分别在0.25 h、0.5 h、1 h、2 h、4 h、6 h、8 h、12 h、24 h、36 h取出样品,放入玻璃离心管内3 500 r/min离心。用巴氏滴管取出上清液放入2 mL自动进样瓶内,2℃保存待测。整个实验过程设两个平行样。
平衡吸附等温线实验:准确称取1.00 g土样于40 mL样品瓶内,称39.9~40.0 g的不同浓度毒死蜱水溶液(0.1~0.8 mg·L-1)于瓶内,旋紧瓶盖,放入25℃,120 r·min-1摇床振荡。根据动力学实验确定吸附平衡时间,平衡振荡后,取出样品,倒入10 mL玻璃离心管,即刻离心分离。用巴氏滴管取出上清液放入2 mL自动进样瓶内,2℃保存待测。整个实验过程设两个平行样。
1.2.3 分析方法采用Waters 2695高效液相色谱仪(配有Waters 2489紫外检测器)分析毒死蜱含量。色谱柱为Hypersil ODS柱(4.6 mm×250 mm,5 μm),等度洗脱流动相条件为乙腈/水(95:5,V:V),流速为1.0 mL·min-1,检测波长为288 nm,柱温25℃,进样量20 μL,保留时间为4.1 min。
吸附动力学与吸附等温线模型数据使用Sigma Plot 12进行拟合,采用Spss 13.0软件分析土壤对毒死蜱的吸附特性与土壤理化性质的相关性。
1)吸附动力学的模型拟合
用伪一级动力学方程和伪二级动力学方程对吸附数据进行拟合,拟合方程分别如下:
| $\frac{\text{d}\left( {{q}_{e}}-{{q}_{t}} \right)}{\text{d}t}={{k}_{1}}\left( {{q}_{e}}-{{q}_{t}} \right),$ | (1) |
| $\frac{\text{d}\left( {{q}_{e}}-{{q}_{t}} \right)}{\text{d}t}={{k}_{2}}{{\left( {{q}_{e}}-{{q}_{t}} \right)}^{2}},$ | (2) |
式中k1和k2分别为伪一级动力学方程和伪二级动力学方程速率常数,qt和qe分别为t时刻和吸附平衡时的吸附量。
2)吸附等温线的模型拟合
土壤与毒死蜱的吸附等温线一般用Linear模型或Freundlich模型拟合。Linear模型[11]常用于解释吸附质在均质吸附剂上以分配作用为主导的吸附现象,方程式如下:
| ${{Q}_{e}}={{K}_{d}}{{C}_{e}},$ | (3) |
式中Qe和Ce分别为固相和液相中吸附质的浓度。Freundlich模型广泛用于吸附质在异质性表面的吸附和多层吸附现象,模型方程式如下:
| ${{Q}_{e}}={{K}_{f}}{{C}_{e}},$ | (4) |
式中,Qe(mg·kg-1)和Ce(mg·L-1)分别为吸附平衡后吸附质在固相和液相的浓度;Kf((mg·kg-1)·(mg·L-1)-n)和n为Freundlich方程常数,分别代表吸附容量和非线性程度。当n<1时,平衡吸附等温线为向下弯曲的凸形曲线;当n>1时,为向上的凹形曲线。
2 结果与讨论 2.1 土壤理化性质如表 1所示,常州地区因酸雨频繁,土壤偏酸性,天津、寿光地区的土壤为中性土壤。常州表层土壤属壤质粘土,其下层土壤、以及天津和寿光土壤质地均为壤土。土壤总矿物质含量(Total quantity of mineral elements, Tm)随深度变化较小,但是由于天津和寿光研究区以地下水为灌溉水,土壤总矿物质含量(主要是铝、钙和镁)高于常州土壤,且天津研究区总矿物质含量最高,主要是该区地下水硬度高所致。但总体而言,3个地区土壤总有机质含量(Total quantity of organic carbon, Toc)随土壤深度变化呈递减趋势。
| 表 1 供试土壤理化性质 Table 1 Physical and chemical properties of the soils investigated |
由图 1可知,3个研究区剖面土壤的毒死蜱吸附量在最初的60 min内均能达到平衡吸附量的60%以上,虽然不同剖面土壤对毒死蜱吸附平衡快慢存在差异,但吸附量均在6 h后趋于平衡。因此,土壤对毒死蜱的吸附可以分为两个阶段,即快速吸附与慢平衡阶段。为保证充足的吸附反应时间,本研究选用24 h为吸附平衡所需时间。
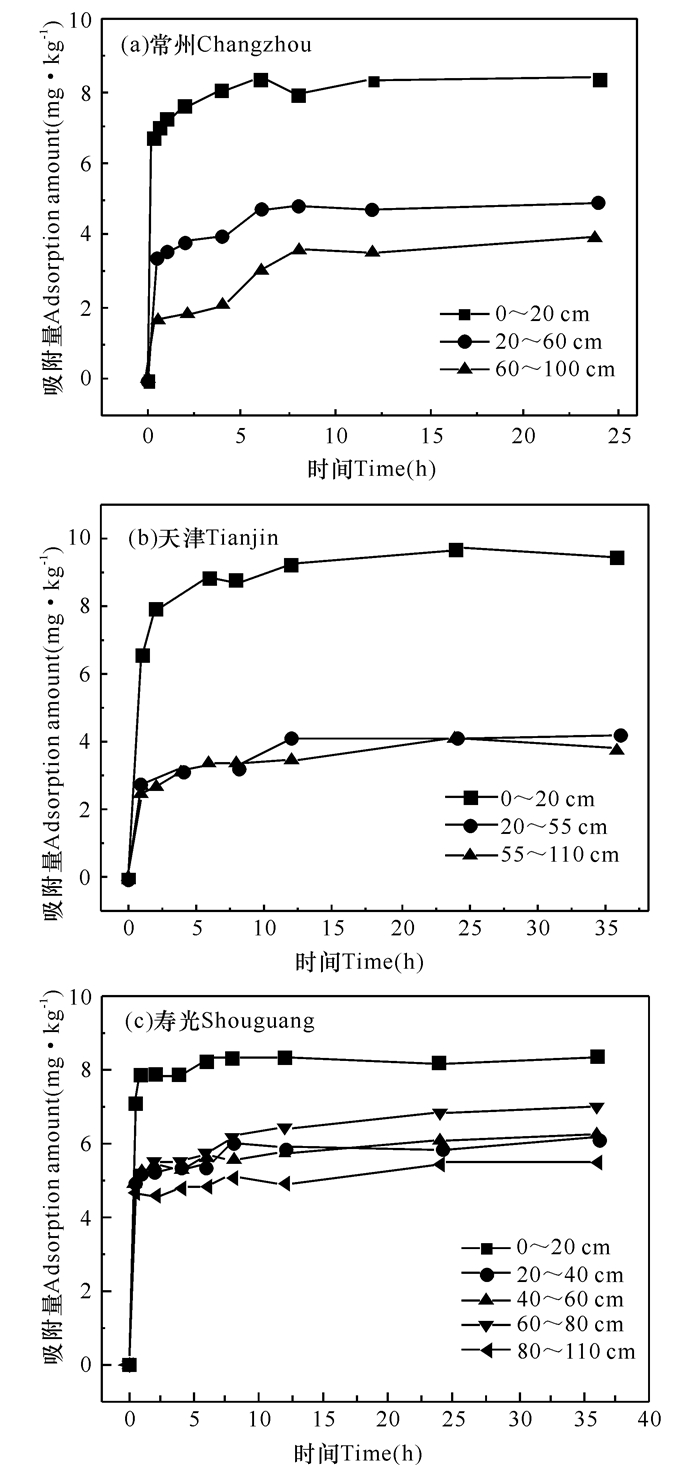
|
图 1 不同剖面土壤吸附毒死蜱动力学曲线 Fig.1 Adsorption dynamic curves of chlorpyrifos in Changzhou (a), Tianjin (b) and Shouguang (c) soils with different depth |
除常州第3层剖面土壤外,伪一级动力学方程和伪二级动力学方程均能较好地对土壤吸附毒死蜱动力学数据进行拟合,但相比之下,伪二级动力学方程能更好地描述不同土壤对毒死蜱的吸附过程,拟合相关系数R2为0.95~0.99(表 2)。动力学模型速率常数k1和k2值均较大,进一步表明吸附速率较快,这主要是由于毒死蜱是疏水性有机物,与土壤有机质有较强的亲和力。总体而言,常州和寿光表层土壤的k1、k2值均较大,且随着土壤深度的增加而减小;天津表层土壤的k1、k2值较小,下层土壤的k1、k2值与常州、寿光下层土壤无显著差异。可见,相同淋溶条件下,与天津土壤相比,毒死蜱在常州和寿光表层土壤中的迁移速率较快;而在下层土壤中的迁移速率与在天津下层土壤中相当。
| 表 2 吸附动力学模型拟合结果 Table 2 Simulated results of adsorption dynamic models |
如表 3所示,3个研究区的剖面土壤与毒死蜱的吸附等温线均能较好的用Frendulich方程拟合(R2=0.93~0.99)。由于土壤的性质各异,利用Freundlich方程求得的吸附常数Kf值为15~302.32,n值为0.52~1.58。表层土壤对毒死蜱吸附呈非线性; 但随着深度的增加,n值增大,土壤对毒死蜱的吸附逐渐呈线性,表示吸附机理由分配作用与吸附作用共同主导逐步向分配作用主导转变。同时表层土壤对毒死蜱的吸附容量Kf明显高于下层土壤,n和Kf值的变化可能主要与土壤有机质含量及成分变化有关[11-14]:表层土壤有机质含量受人为活动影响较下层土壤高,且组成成分也较为复杂。此外,天津剖面土壤对毒死蜱的吸附特性与常州和寿光土壤存在较大差异,可能与土壤矿物含量高有关[15]。
| 表 3 吸附等温线方程拟合结果 Table 3 Sorption isotherm parameters for sorption of chlorpyrifos to soils |
由于Kf单位中有n值,且本研究中不同土壤吸附毒死蜱的n值存在较大差异,Kf不能直接用于比较土壤对毒死蜱的吸附能力,因此引入单点标化的土壤有机碳分配系数Koc值比较毒死蜱在各层土壤中的迁移能力,计算公式为
| $ {{K}_{oc}}={{K}_{f}}C_{e}^{n-1}/{{f}_{oc}}, $ |
式中foc为有机碳百分含量,另外取Ce/Sw=0.005,0.05和0.5,其中Sw为吸附质在水中的溶解度,毒死蜱在水中的溶解度为1.12 mg·L-1(文献[1]),即Sw=1.12 mg·L-1。
毒死蜱在3个研究区剖面土壤中的标化分配系数Koc存在较大差异(表 4),可能是土壤有机质类型不同所引起的[16]:本研究所采集的土壤分别属于南方水稻土和北方蔬菜种植土,气候和施肥模式等的不同使得土壤所含有机质类型差异较大。由Koc值可知,高平衡浓度下,相比于天津土壤,常州和寿光上层土壤有机质对毒死蜱的吸附能力较差;相同淋溶条件下,常州和寿光表层土壤中的毒死蜱向下层迁移的量更高。天津表层土壤有机质对高浓度毒死蜱具有较强的吸附能力,大部分毒死蜱被截留在表层中,到达下层土壤时浓度已大大降低。因此,毒死蜱在土壤中的迁移能力为常州≈寿光>天津;相反,当污染浓度较低时,毒死蜱在天津土层中最易移动,而在其它两个地区的土壤移动能力相对较弱。总体而言,单点标化Koc值小于550,根据Koc分级结果[17],毒死蜱在3个研究区土层中均属于较易移动类型。
| 表 4 不同剖面土壤吸附毒死蜱的单点标化Koc值 Table 4 Concentration dependent distribution coefficients (Koc) for sorption of chlorpyrifos to different soil profiles |
常州、寿光土壤对毒死蜱的吸附速率常数k1、k2与矿物含量无关(R<0.5),而与土壤总有机质含量(Toc)显著线性相关,相关系数分别为R1=0.866 2(P=0.00)和R2=0.674(P=0.011),具体结果如图 2。天津表层土壤所含的有机碳较高,但其吸附速率常数k1和k2均较低,这可能是由于其所含有的矿物质较多,使得土壤对毒死蜱的吸附机制发生改变,吸附速率也因此而降低[18]。
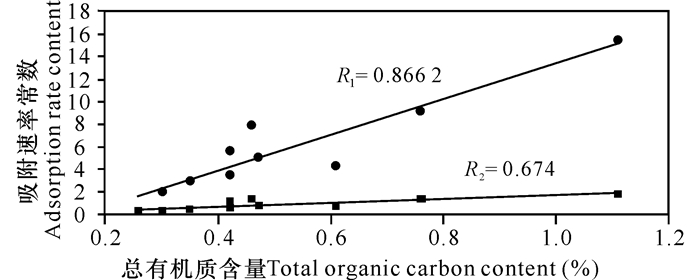
|
图 2 吸附速率常数k1和k2与Toc线性相关性 Fig.2 Linear correlation of adsorption kinetics parameters (k1 and k2) with total organic carbon content (Toc) |
经Spss线性相关分析可知(表 5),土壤对毒死蜱的吸附容量Kf值主要取决于有机物含量(R=0.930,P=0.01),这与现有研究结论一致:当土壤有机碳含量大于0.1%时,有机质是土壤吸附疏水性有机物的决定性因素[19-20]。但是当土壤有机质类型及含量相近时,矿物含量的增加会降低土壤对毒死蜱的吸附:寿光20~40 cm与60~80 cm两层土壤总有机质含量均为0.42%,60~80 cm土壤总矿物质含量(10.439%)高于20~40 cm土壤(9.233%),60~80 cm土壤对毒死蜱的吸附能力则略低于20~40 cm土壤;而寿光80~110 cm土壤所含总有机质量为0.3%,总矿物质含量为8.815%,该层土壤吸附毒死蜱能力却高于20~40 cm土壤。已有研究表明这一现象主要是因为矿物质与有机质作用会减少有机质与疏水性有机物的表面吸附位点[21],然而当总有机质含量高于2%时,矿物质表面将被有机质占据,矿物质对有机质吸附的削弱作用将非常微弱[22]。
| 表 5 吸附参数与土壤理化性质相关性 Table 5 Correlations between sorption parameters and physico chemical properties of soil |
上述吸附特征参数通常是AF参数法和GUS值法等风险指数法评价农药污染地下水风险的重要指标值之一,然而它们往往需要大量的实验数据。由于非线性程度n值主要由总矿物质含量Tm、阳离子表面交换量CEC以及总有机质含量Toc决定,且n值与矿物含量及有机碳含量呈正相关,与阳离子表面交换量呈负相关。通过Spss线性回归分析,采用影响土壤与有机物吸附的3个土壤理化因素表示吸附常数n值和Kf值,得出经验公式分别如下:
| $\begin{align} & n=1.679+0.111*{{\text{T}}_{\text{oc}}}-0.145*\text{CEC+} \\ & \text{0}\text{.039}{{\text{T}}_{\text{m}}}\left( {{R}^{2}}=0.891,P=0.001 \right), \\ \end{align}$ | (5) |
| $\begin{align} & {{K}_{f}}=33.399*{{\text{T}}_{\text{oc}}}-8.796*\text{CEC-} \\ & \text{1}\text{.679}*{{\text{T}}_{\text{m}}}-111.292\left( {{R}^{2}}=0.906,P=0.001 \right). \\ \end{align}。$ | (6) |
将常州、寿光和天津土壤的Tm、CEC和Toc值代入公式(5)和(6)中,分别计算得到Kf和n值,由公式Koc=Kf Cen-1/foc进一步计算得到Koc值。将计算得到的与实测的Kf、n以及单点标化Koc值进行相关分析,得出的相关性系数分别为R2=0.906, 0.896以及0.780(Ce/Sw=0.5,P=0.001)。因此,采用表达式(5)(6)估算不同土壤对毒死蜱的吸附特征参数值(Kf、n和单点标化Koc)是可行的。
本研究中经验式(5)(6)只需土壤常规理化性质即可计算出吸附特征参数,可为毒死蜱污染地下水风险评价中这些重要指标值的获得提供简单可行的方法。
2.5 研究区毒死蜱地下水污染风险分析毒死蜱在田间施用量大且频繁,所以本研究仅讨论高浓度段下,毒死蜱对3个研究区地下水的污染风险。Koc值已表明在相同淋溶条件下,毒死蜱在常州水稻土和寿光蔬菜种植土中的迁移能力相近,且高于天津土壤。但由于田间条件、降雨量、灌溉水质及水量的差异,使得毒死蜱在常州水稻土与北方两地区蔬菜种植土中的迁移能力发生较大变化。常州水稻田灌溉量大,田间始终保持至少1 cm深度的水层,灌溉水基本取自周边河水,其溶解性有机质含量相对较高,且南方降雨量大,水稻种植期多处于夏季,暴雨频繁。相比之下,天津和寿光蔬菜种植区灌溉量和降雨量均相对较少,且灌溉水为地下水,水溶性有机质少,毒死蜱不易随水流向下迁移。另外常州地下水埋深仅为2 m左右,寿光地区地下水埋深则高达30 m。因此,毒死蜱对3个研究区地下水污染风险大小为常州>寿光>天津。
3 结论吸附实验结果表明土壤对毒死蜱的吸附是一种快吸附慢平衡过程,符合二级动力学吸附规律(R2=0.95~0.99)。除天津表层土壤外,3种剖面土壤吸附速率常数相近,且随土壤深度呈现递减趋势。土壤吸附毒死蜱等温线能较好的利用Freundlich方程拟合,其中,吸附参数n值主要由Toc、阳离子表面交换量(CEC)以及总矿物质含量(Tm)共同决定,Kf值则主要与有机质含量有关。线性回归方程能被用于估算Kf、n以及单点标化Koc值,估算值与实测值相关系数R2分别达到0.906, 0.896以及0.780,可为毒死蜱污染地下水风险评价中相关指标值的获得提供简单可行的方法。
| [1] |
GEBREMARIAM S Y, BEUTEL M W, YONGE D R, et al.Adsorption and desorption of chlorpyrifos to soils and sediments[M]//DAVID M W (ed.).Reviews of Environmental Contamination and Toxicology.New York:Springer, 2012, 215:123-175.
|
| [2] |
BORTOLUZZI E C, RHEINHEIMER D S, GONCALVES C S, et al. Investigation of the occurrence of pesticide residues in rural wells and surface water following application to tobacco[J]. Química Nova, 2007, 30(8): 1872-1876. DOI:10.1590/S0100-40422007000800014 |
| [3] |
姜莉莉, 武玉国. 毒死蜱环境安全性进展[J]. 农药科学与管理, 2014, 35(1): 29-34. JIANG L L, WU Y G. Research progress on environmental safety of chlorpyrifos[J]. Pesticide Science and Administration, 2014, 35(1): 29-34. |
| [4] |
李典宝, 张玮, 王丽卿, 等. 锯齿新米虾对Cu2+和毒死蜱毒性的生理响应[J]. 环境科学, 2015, 36(2): 727-735. LI D B, ZHANG W, WANG L Q, et al. Physiological response of neocaridina denticulate to the toxicity of Cu2+ and chlorpyrifos[J]. Environmental Science, 2015, 36(2): 727-735. |
| [5] |
赵颖, 姚苏梅, 刘毅华, 等. 毒死蜱对我国南方稻区水域中12种淡水鱼的毒性[J]. 生态毒理学报, 2014, 9(6): 1181-1188. ZHAO Y, YAO S M, LIU Y H, et al. Toxic effects of chlorpyrifos on different species of freshwater fish in Southern China[J]. Asian Journal of Ecotoxicology, 2014, 9(6): 1181-1188. |
| [6] |
孙宝利, 曾希柏. 毒死蜱有毒代谢物3, 5, 6-TCP在土壤中的吸附-解吸研究[J]. 农业环境科学学报, 2011, 30(6): 1114-1120. SUN B L, ZENG X B. Adsorption-desorption behavior of chlorpyrifos toxic metabolite 3, 5, 6-TCP on soils[J]. Journal of Agro-Environment Science, 2011, 30(6): 1114-1120. |
| [7] |
朱丽珺, 张维, 张金池, 等. 毒死蜱和三唑磷在膨润土和腐殖质上的热力学吸附及影响因素[J]. 环境科学, 2010, 31(11): 2699-2704. ZHU L J, ZHANG W, ZHANG J C, et al. Thermodynamics adsorption and its influencing factors of chlorpyrifos and triazophos on the bentonite and humus[J]. Environmental Science, 2010, 31(11): 2699-2704. |
| [8] |
韩玲娟, 宋稳成, 王鸣华. 己唑醇在土壤中的吸附-解吸特性[J]. 环境化学, 2012, 31(3): 367-371. HAN L J, SONG W C, WANG M H. Adsorption-desorption characteristics of hexaconazole in soils[J]. Environmental Chemistry, 2012, 31(3): 367-371. |
| [9] |
魏沙平, 李红陵, 陈飞霞, 等. 土壤腐殖酸对毒死蜱的吸附[J]. 环境科学学报, 2007, 27(10): 1675-1680. WEI S P, LI H L, CHEN F X, et al. Sorption of chlorpyrifos in humic acid[J]. Acta Scientiae Circumstantiae, 2007, 27(10): 1675-1680. |
| [10] |
孙扬, 杨挺, 皇甫伟国, 等. 毒死蜱和氰戊菊酯在土壤中的吸附与迁移[J]. 农药学学报, 2007, 9(4): 397-404. SUN Y, YANG T, HUANGFU W G, et al. Adsorption and mobility of chlorpyrifos and fenvalerate in soils[J]. Chinese Journal of Pesticide Science, 2007, 9(4): 397-404. |
| [11] |
郭华, 朱红梅, 杨红. 除草剂草萘胺在土壤中的降解与吸附行为[J]. 环境科学, 2008, 29(6): 1729-1736. GUO H, ZHU H M, YANG H. Degradation and adsorption behavior of napropamide in soils[J]. Environmental Science, 2008, 29(6): 1729-1736. |
| [12] |
李学垣. 土壤化学[M]. 北京: 高等教育出版社, 2001. LI X Y. Soil Chemistry[M]. Beijing: Higher Education Press, 2001. |
| [13] |
刘维屏, 季瑾. 农药在土壤-水环境中归宿的主要支配因素--吸附和脱附[J]. 中国环境科学, 1996, 16(1): 25-30. LIU W P, JI J. One of the most important factos affecting the fate of pesticide in soil-water environmental:Sorption and desorption[J]. China Environmental Science, 1996, 16(1): 25-30. |
| [14] |
SITE A D. Factors affecting sorption of organic compounds in natural sorbent/water systems and sorption coefficients for selected pollutants.A review[J]. Journal of Physical and Chemical Reference Data, 2001, 30(1): 187-439. DOI:10.1063/1.1347984 |
| [15] |
谢显传, 张少华, 王冬生, 等. 阿维菌素土壤吸附特性研究[J]. 中国农业科学, 2007, 40(9): 1959-1963. XIE X C, ZHANG S H, WANG D S, et al. Adsorption of abamectin in soil[J]. Scientia Agricultura Sinica, 2007, 40(9): 1959-1963. |
| [16] |
罗雪梅, 杨志峰, 何孟常, 等. 土壤/沉积物中天然有机质对疏水性有机污染物的吸附作用[J]. 土壤, 2005, 37(1): 25-31. LUO X M, YANG Z F, HE M C, et al. Sorption of hydrophobic organic contaminants by natural organic matter in soils and sediments[J]. Soil, 2005, 37(1): 25-31. |
| [17] |
SEGER M R, MACIEL G E. NMR investigation of the behavior of an organothiophosphate pesticide, chlorpyrifos, sorbed on soil components[J]. Environmental Science & Technology, 2006, 40(3): 791-796. |
| [18] |
VAN EMMERIK T J, ANGOVE M J, JOHNSON B B, et al. Sorption of chlorpyrifos to selected minerals and the effect of humic acid[J]. Journal of Agricultural and Food Chemistry, 2007, 55(18): 7527-7533. DOI:10.1021/jf071084z |
| [19] |
CHEN W, SONG L R, GAN N Q, et al. Sorption, degradation and mobility of microcystins in Chinese agriculture soils:Risk assessment for groundwater protection[J]. Environmental Pollution, 2006, 144(3): 752-758. DOI:10.1016/j.envpol.2006.02.023 |
| [20] |
CORNEJO J, CELIS R, PAVLOVIC I, et al. Interactions of pesticides with clays and layered double hydroxides:A review[J]. Clay Minerals, 2008, 43(2): 155-175. DOI:10.1180/claymin.2008.043.2.01 |
| [21] |
AHMAD R, KOOKANA R S, ALSTON A M, et al. The nature of soil organic matter affects sorption of pesticides.1.Relationships with carbon chemistry as determined by 13C CPMAS NMR spectroscopy[J]. Environmental Science & Technology, 2001, 35(5): 878-884. |
| [22] |
WU C X, ZHANG S Z, NIE G, et al. Adsorption and desorption of herbicide monosulfuron-ester in Chinese soils[J]. Journal of Environmental Sciences, 2011, 23(9): 1524-1532. DOI:10.1016/S1001-0742(10)60583-9 |
 2016, Vol. 23
2016, Vol. 23 


