2. 中国科学院烟台海岸带研究所, 山东烟台 264003;
3. 中国科学院大学, 北京 100049
2. Yantai Institute of Coastal Zone Research, Chinese Academy of Sciences, Yantai, Shandong, 264003, China;
3. University of Chinese Academy of Sciences, Beijing, 100049, China
【研究意义】大型底栖动物大多生活在有氧和有机质丰富的沉积物表层,并通过作用于底层水体和沉积物环境参与水体-沉积物界面的营养物质循环,影响污染物的迁移转化与沉积物的稳定性,在海洋生态系统的能流与物流中占有重要地位[1]。由于其活动能力弱,生活也相对稳定,且不同物种对海洋环境污染反应敏感程度不一,长期以来一直作为生态系统变化的环境指示种[2]。底栖动物的种类组成、区域分布及多样性特征等与其生存的环境密切相关,盐度、沉积质的特征和人为扰动等因素的变化都会引起底栖动物种类、数量、分布及生物多样性的改变[3]。因此对大型底栖动物群落生态特征的研究对了解底栖动物群落的动态变化、生态系统健康评估、科学管理及海洋生物资源合理利用具有重要的意义。【前人研究进展】国内外已开展不少有关排污对底栖动物群落结构影响的调查和研究。贾树林等[4]调查生活污水、工业排污等有机污染对锦州湾底栖生物群落的影响,发现环境受扰动海域的优势种为多毛类,且呈现小型化趋势;Tabatabaie等[5]对波斯湾西北边缘的加纳姆河进行调查,发现邻近污水处理厂的海域主要物种为多毛类。国内学者也先后进行不同地区的调查研究,如排污对锦州湾大型底栖动物生态的影响[4]、环境污染对小清河口大型底栖动物多样性的影响[3]、污水排海对小型底栖生物丰度和生物量的影响[6]、厦门市多个排污口对厦门湾大型底栖动物群落的干扰[7]。何明海等[8]发现在厦门西港污染海域,随污染程度的增加,多毛类数量增加,棘皮动物数量减少,甚至绝迹。【本研究切入点】目前尚未有对芝罘岛附近海域大型底栖动物进行全面的物种多样性和多样性分布格局及其与环境因子关系的报道。【拟解决的关键问题】利用2012年9月对芝罘岛附近海域大型底栖动物的调查结果,分析芝罘岛附近污水排放对该海域大型底栖动物群落结构的影响,借此了解污水排放等人类活动对烟台近海海洋资源的影响程度,为近岸海区生物多样性保护的可持续和海洋环境生态监测利用提供科学依据。
1 材料与方法 1.1 站位设置与样品采集依据距离芝罘岛排污口位置的不同,共布设10个采样站位(图 1)。使用取样面积为0.05 m2的抓斗式采泥器,每个站位取3个平行样品,合并为1个样品。采用0.5 mm孔径的网筛对样品进行分选,并使用75%酒精进行现场固定,带回实验室进行分类鉴定至种或属级水平,并进行个体计数及称重(天平精度为0.001 g)。样品的处理、保存、计数和称重均按照《海洋调查规范》(GB/T 12763.6—2007)进行。水深、水温(WT)、盐度(Sal)、溶解氧(DO)和pH值等环境因子利用YSI环境监测系统(600QS-M-O,美国)现场测定。营养盐利用营养盐自动流体分析仪进行测定,测定标准为《海洋监测规范第4部分:海水分析》(GB 17378.4—2007)。
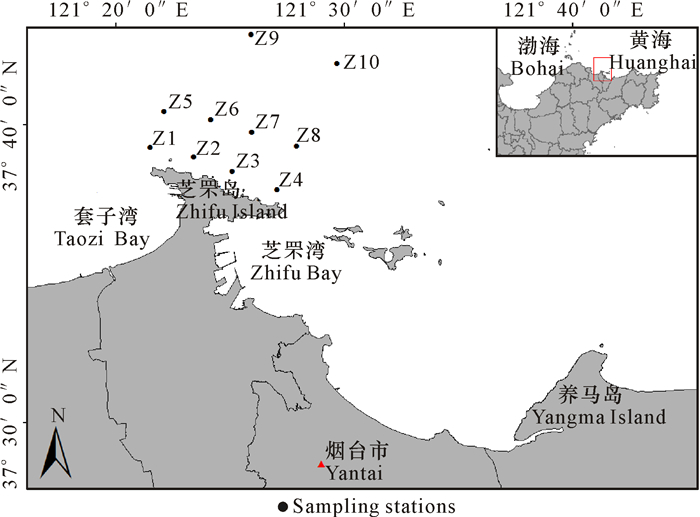
|
图 1 调查海域及采样位点 Fig.1 Servey areas and sampling stations |
大型底栖动物的群落多样性采用优势度Y、Shannon-Wiener多样性指数(H′)、Margalef物种丰富度指数(D′)和Pielou物种均匀度指数(J′)进行分析。其中,
优势度
Shannon-Wiener多样性指数
Margalef物种丰富度指数
Pielou物种均匀度指数(J′)=H′/log2S,
式中,N为所有站位采泥样品中的所有大型底栖动物的总个体数目,ni为第i种底栖动物的个体数,fi为该物种在各站位出现的频率,S为样品的种类总数,Pi为第i种的个体数与样品中总个数的比值(Ni/N)。当Y>0.02时,该种即为优势种[9]。
1.2.2 群落结构分析采用生物统计分析软件PRIMER 6.0进行分析:使用经平方根转化后的物种丰度数据计算站位间的Bray-Curtis相似性系数,并构建相似性矩阵;然后采用等级聚类分析CLUSTER和非度量多维标度(non-metric multi-dimensional scaling,MDS)排序方法分析大型底栖动物的群落结构。在聚类分析的基础上,应用单因子相似性分析(One-way analysis of similarities,One-way ANOSIM)检验各聚类组间种类组成的差异显著性。采用相似性百分比分析(Similarity percentage program)了解不同物种对样品各组内相似性和组间差异性的平均贡献率[10]。
1.2.3 群落生态特征与环境因子相关性分析对所有站位的环境参数进行PCA(Principal Component Analysis,PCA)分析,各站位的分析结果构成一个图谱,该图谱呈现各站的相似程度[11]。图谱中两站位间的距离与两站位间的环境变量相异程度一致,主成分分析数据表示站位在图谱中的位置。采用Primer软件的RELATE对群落丰度和生物量与环境因子之间的关系进行分析;使用BIOENV分析单一环境因子与底栖动物群落结构的相关系数;利用SPSS16.0软件中Pearson相关性分析对生物多样性指数与环境因子进行相关性分析。
1.2.4 丰度/生物量比较曲线丰度/生物量比较曲线(abundance and biomass curves,ABC曲线)是在同一坐标系比较丰度优势度曲线和生物量优势度曲线,通过两曲线的分布来分析大型底栖动物群落的受干扰状况:若生物量优势度曲线在丰度优势度曲线之上,说明群落未受扰动;若丰度优势度曲线和生物量优势度曲线相交,说明群落受到中等程度扰动;若生物量优势度曲线在丰度优势度曲线之下,则说明群落受到严重扰动[12]。
2 结果与分析 2.1 大型底栖动物的种类组成及优势种分析本次调查共采集到大型底栖动物63种,其中多毛类35种,占物种总数的55.56%;软体动物13种,占物种总数的20.63%;甲壳动物11种,占物种总数的17.46%;棘皮动物3种,占物种总数的4.76%;其他动物1种,占物种总数的1.59%。
优势种有9种,其中多毛类7种,甲壳动物与软体动物各1种,均为耐污性较强的底栖种类,主要包括多毛类不倒翁虫Sternaspis sculata(Y=0.131)、双唇索沙蚕Lumbrineris cruzensis(Y=0.069)、西方似蛰虫Amaeana occidantalis(Y=0.047)、拟特须虫Paralacydonia paradoxa(Y=0.044)、寡节甘吻沙蚕Glycinde gurjanovae(Y=0.040)、多鳃齿吻沙蚕Nephtys polybranchia(Y=0.034)、丝异蚓虫Heteromastus filiformis(Y=0.030)和甲壳动物塞切尔泥钩虾Eriopisella sechellensis(Y=0.084),以及软体动物彩虹明樱蛤Moerella iridescens(Y=0.072)。各站位均有优势种分布,且各优势种出现的频次均达站位总数的一半以上。耐污性较强的丝异蚓虫的发现,说明该海域已经受到一定程度的污染。
2.2 生物量和丰度在生物量方面,软体动物的平均生物量最高,为2.49 g/m2,占总平均生物量的29.98%;多毛类的平均生物量为1.89 g/m2,占总平均生物量的22.83%;棘皮动物的平均生物量为0.83 g/m2,占总平均生物量的10.05%;甲壳动物的平均生物量为0.67 g/m2,占总平均生物量的8.04%。生物量在各采样点的空间分布不均,远离排污口的各采样点的生物量普遍高于排污口邻近区域的生物量(图 2)。
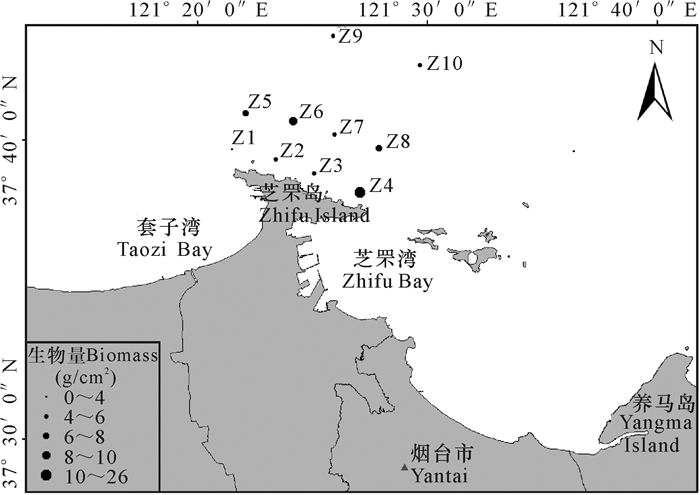
|
图 2 芝罘岛近岸海域大型底栖动物生物量的空间分布 Fig.2 Spatial distribution of macrobenthic biomass in the water areas of Zhifu Island |
在丰度方面,多毛类占绝对优势,平均丰度最高,为390.67 ind./m2,占总平均丰度的63.15%;甲壳动物次之,平均丰度为121.33 ind./m2,占总平均丰度的19.61%;软体动物的平均丰度为94.67 ind./m2,占总平均丰度的15.30%;棘皮动物和其他动物的平均丰度均为6 ind./m2,均占总平均丰度的0.97%。丰度在各采样点的分布不均,低值区位于排污口附近的Z2站位(图 3)。
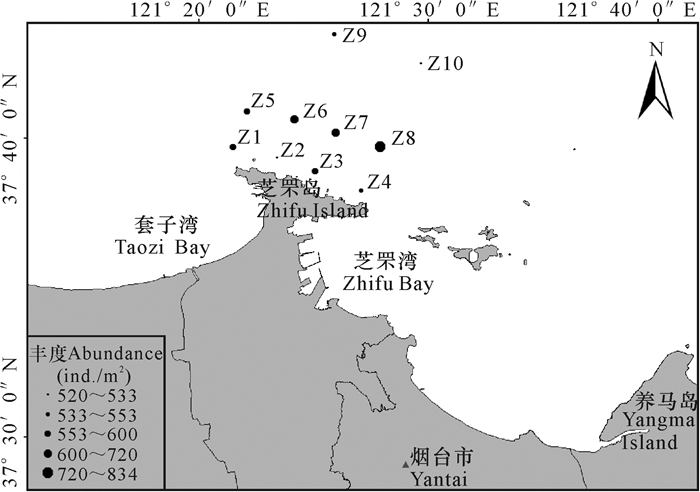
|
图 3 芝罘岛近岸海域大型底栖动物丰度的空间分布 Fig.3 Spatial distribution of macrobenthic abundance in the water areas of Zhifu Island |
CLUSTER聚类和MDS排序的分析结果一致(图 4)。在60%的相似性水平上,该群落可分为3组,One-way ANOSIM分析结果表明不同的群落组间差异性达到显著性水平(R=0.964,P=0.008)。具体分组情况如下:
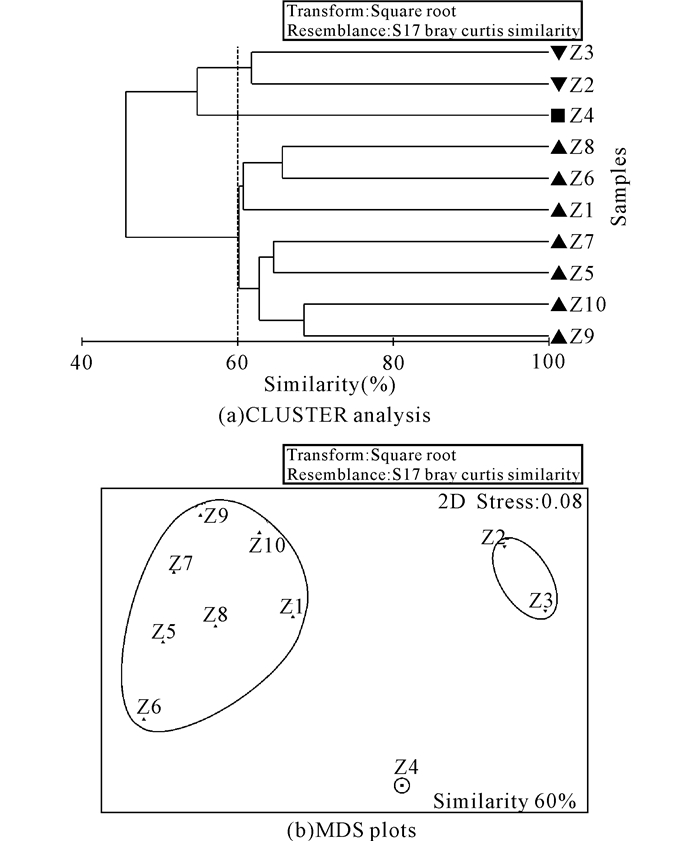
|
图 4 芝罘岛近岸海域大型底栖动物群落的CLUSTER聚类分析与MDS标序结果 Fig.4 CLUSTER analysis and MDS plots of macrobenthos in the water areas of Zhifu Island |
组Ⅰ,由Z2站和Z3站组成,组内平均相似性为61.78%。贡献率超过5%的共有8种,贡献最大的是不倒翁虫,贡献率为22.29%;其次是彩虹明樱蛤和寡节甘吻沙蚕,贡献率均为9.42%。
组Ⅱ,只包括Z4站,无法进行组内相似性分析和主要贡献种分析。
组Ⅲ,包括Z1、Z5、Z6、Z7、Z8、Z9、Z10等7个站,组内平均相似性为61.61%。21个物种的累计贡献率高达90.83%,贡献率较高的几个主要物种为塞切尔泥钩虾、拟特须虫、西方似蛰虫和彩虹明樱蛤,贡献率分别为10.44%、7.67%、7.30%和7.25%。
2.4 物种多样性各采样站位的丰富度指数(D′)均相对较高,平均值为5.469±0.417,其中Z5站最高,为6.266;Z9站仅次于Z5,为5.722;离排污口最近的Z2站最低,为4.831。调查海域的大型底栖动物群落在各站位的分布相对均匀,均匀度指数(J′)的平均值为0.965±0.007,最高值出现在离排污口较远的Z5、Z9和Z10站,其值均为0.971;Z3站最低,为0.955。多样性指数(H′)在站位间没有明显的差异,平均值为3.173±0.102,Z5站最高,为3.335;Z2站最低,为3.001。
2.5 环境因子与群落结构的关系采用PCA分析调查海域的环境因子,结果表明两排序轴的信息量占总信息量的67.9%。基于环境因子的相似性,调查站位大致可分为3组:Z2、Z3、Z5、Z7和Z10站相似,聚为一组;Z4站明显不同于其他站位,单独聚为一组;剩余其他站位为一组。前5个主成分的累计贡献率达到97.9%,其对应负荷矩阵如图 5。第一主成分中主要的环境因素是硅酸-硅、总氮、铵盐-氮、磷酸-磷和硝酸-氮;第二主成分中主要的环境因素是pH值、水温、溶解氧、盐度和硝酸-氮。
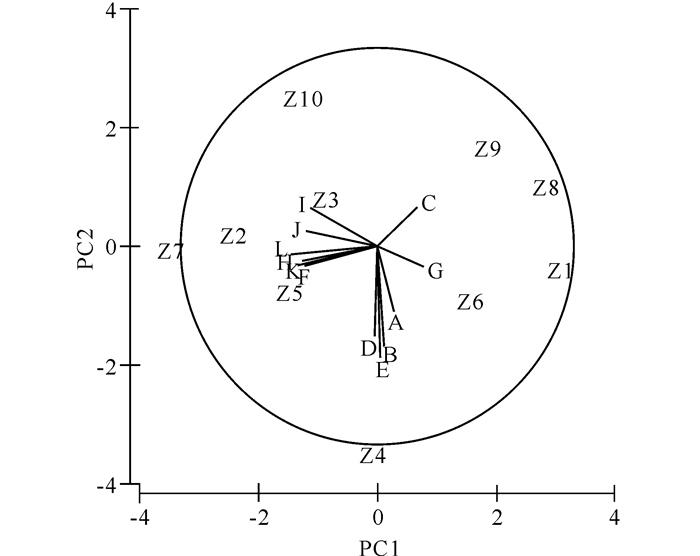
|
A:水深; B:水温; C:盐度; D:溶解氧; E:pH值; F:磷酸-磷; G:总磷; H:铵盐-氮; I:亚硝酸-氮; J:硝酸-氮; K:总氮; L:硅酸-硅 A:Water depth; B:Water temperature; C:Salinity; D:Dissolved oxygen; E:pH value; F:Phosphoric acid-phosphorus; G:Total phosphorus; H:Ammonium salt-nitrogen; I:Nitrous acid-nitrogen; J:Nitric acid-nitrogen; K:Total nitrogen; L:Silicic acid-silicon 图 5 调查站位环境因子主成分分析排序图 Fig.5 Ordination of sampling stations by Principal Component Analysis on environmental variables |
BIOENV分析结果表明,水深、溶解氧和亚硝酸-氮的组合与丰度、生物量的相关系数相对较高(与丰度的相关系数为0.604,与生物量的相关系数为0.536),最能解释环境因子与群落结构的关系及丰度与生物量的空间分布特征。
各生物多样性指数与环境因素的Pearson相关性分析表明,均匀度指数(J′)与盐度呈显著正相关,其他相关性均不显著(表 1)。
| 表 1 生物多样性指数与环境因子的Pearson相关分析 Table 1 Pearson correlation between environmental variables and biodiversity indices |
基于聚类分析结果,对调查海域各站位大型底栖动物的丰度和生物量作出ABC曲线(图 6)。从ABC曲线情况看,Z1、Z2、Z3、Z5、Z6、Z7、Z8、Z9、Z10站的丰度优势度曲线与生物量优势度曲线接近重合并出现交叉,且生物量优势度曲线起点低,即优势度不明显,说明该区域大型底栖动物群落受到中等程度的扰动,大型底栖动物群落逐渐趋向于由一种或几种较小的种类占优势。Z4站的生物量优势度曲线始终在丰度优势度曲线之上,说明其所在海域的大型底栖动物群落未受到扰动。
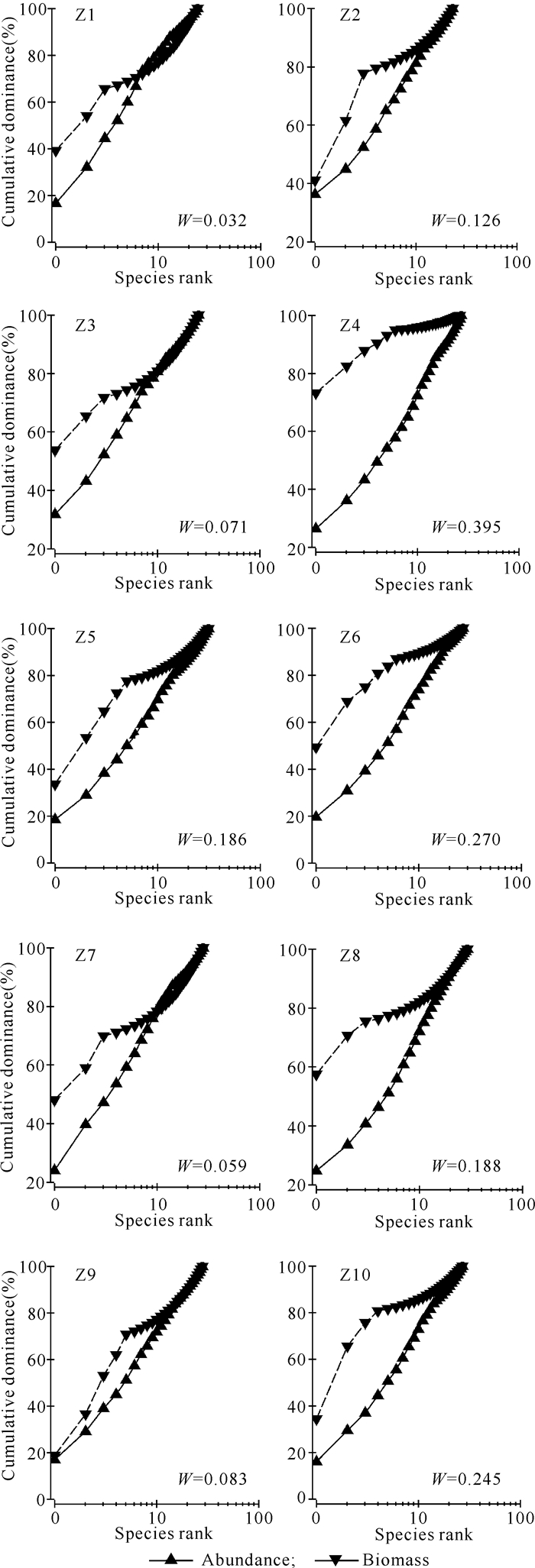
|
图 6 芝罘岛邻近海域所有站位的ABC曲线 Fig.6 ABC curves at all sampling stations in the water area of Zhifu Island |
本次调查共获大型底栖动物63种,其中多毛类占绝对优势,为35种;其次是软体动物和甲壳动物,软体动物和甲壳动物的种类数所占比例差别不大;棘皮动物较少;其他类群生物最少,仅发现一种。这次调查结果与1985年7月至1986年6月的烟台近海底栖动物调查结果基本相符:烟台近海四个季度大型底栖动物群落均以多毛类占绝对优势,软体动物次之,甲壳动物居第三位,棘皮动物较少,其他类底栖动物最少[13]。
西沙旺污水处理厂的排污口位于芝罘岛西北端摩罗石附近的海域[14],离排污口最近的Z2站多毛类的生物量远高于其他站位,同时发现耐污性较强的丝异蚓虫,未发现棘皮动物。在一定环境污染下,随着污染的增加,多毛类数量也会随之增多,棘皮动物数量则会减少,甚至绝迹[8]。大型底栖动物同时受到水环境和底质环境影响,因此,即使是在同一海区,底栖动物的生物多样性可能会由于不同的水文条件呈现出差异[15]。刘晓收等[16]认为水深、盐度和温度等水层环境对渤海大型底栖动物多样性的影响要大于沉积环境的影响,本研究也发现环境因子如水深、溶解氧、亚硝酸盐-氮、硝酸盐-氮等与底栖动物丰度、生物量的相关系数最高,说明随着烟台市经济的发展及和人口的增长,工业废水与生活污水的不断排放入海对芝罘岛附近海域的底栖动物群落产生一定的影响。溶解氧是影响底栖动物分布及群落结构的重要影响因子,当水体中的溶解氧低于2 mg/L时,底层拖网作业基本没有渔获量[17],而本次调查研究海域的大型底栖动物也主要分布于溶解氧相对较高的区域。无机氮是衡量水体富营养化程度的重要指标,水体富营养化也是影响大型底栖动物群落的重要因素[18]。本研究中无机氮含量较低的站位生物分布较少,说明水体中无机氮的含量已经对芝罘岛附近海域的大型底栖动物产生负面影响。
各站位大型底栖动物群落所受扰动程度不一,局部区域受到较大程度的扰动,特别是位于排污口附近的Z2站。Z2站底栖动物群落的丰度优势度曲线起点较高,表明一些机会种的数量开始增加,Z2站的底栖动物群落受到环境的影响,物种组成单一,且个体较小的种占优势,说明受污染区域给耐污性较强的多毛类等小型物种提供更多的生存机会。
3.2 烟台近海区域的大型底栖动物群落在20世纪90年代,位于芝罘区北部的芝罘湾由于长期受陆源和航运排污物的影响,水质偏重富营养化,耐污性较强的多毛类动物占绝对优势[19];2010—2011年王全超等[20]对烟台近海进行大型底栖动物群落的调查,结果显示群落优势种均为多毛类,优势种种类数量减少,物种出现小型化趋势,群落组成结构单一;而2012年对大沽夹河底栖动物调查结果也显示,多毛类所占比例最高,其次是软体动物和甲壳动物,棘皮动物和其他类群生物较少[21]。总的来说,近30年来烟台近海大型底栖动物群落组成没有显著的变化,均发现耐污性较强的丝异蚓虫。丝异蚓虫由于其独特的栖息环境,被作为海洋污染区的指示种[22]。污染指示种一旦大量出现,往往预示着该区域的环境已经受到污染。
烟台近海水域是黄渤海区重要的作业渔场,该海域关于大型底栖动物的历史数据相对较少。对相同区域的历史调查仅有1985年7月至1986年6月的大型底栖动物调查[13],为减少误差,选取与本研究调查相同季节的数据进行比较,结果发现该区域的物种数、丰度和生物量相比于芝罘岛外海区大范围的调查差异较大,但物种组成上没有明显的差异,可能与站位布设和调查范围大小有关。2012年9月对烟台大沽夹河河口及邻近海域进行大型底栖动物调查,通过比较发现烟台大沽夹河河口及邻近海域的调查中优势种有4种,均为多毛类,且逐渐呈现小型化和种类减少的趋势[21]。本次调查发现9种优势种,其中多毛类7种,甲壳类和软体动物各1种,不倒翁虫和丝异蚓虫为两次调查共有的优势种,说明多毛类成为烟台近海群落中的绝对优势类群。随着工业和经济迅速发展及人口不断增加,环境问题日益严重,其他海域的大型底栖动物群落也出现物种小型化、群落组成简单的趋势。莱州湾及渤海中部大型底栖动物的种类组成和群落结构也发生改变,朝向更小型的多毛类和甲壳类比例增加,而体型较大的棘皮动物和双壳类软体动物种类减少的方向发展[23]。
4 结论水深、溶解氧与总氮含量是影响本研究海域大型底栖动物群落空间分布的关键环境因子,且该海域部分站位的底栖动物群落受到中等程度的扰动。结合历史材料发现,调查区域大型底栖动物群落物种呈小型化趋势,物种组成单一,多毛类占绝对优势。
烟台市是我国对外开放的沿海城市之一,也是重要的旅游城市和外贸港口。在20世纪80年代中期以前,烟台还未受到重大污染,水质也处于良好的状态。但进入20世纪80年代中期之后,随着工业和经济的迅速发展及人口的不断增加,工业排污与生活排污成为重要的污染来源,造成烟台附近海域的水质污染[14]。加强烟台附近海域污染源的治理力度,严格控制工业和生活污水排放,对烟台近岸海域水质及生态环境的改善具有重要意义。
| [1] |
刘晓收, 范颖, 史书杰, 等. 渤海大型底栖动物种类组成与群落结构研究[J]. 海洋学报, 2014, 36(12): 53-66. LIU X S, FAN Y, SHI S J, et al. Studies on the species composition and community structure of macrofauna in the Bohai Sea, China[J]. Acta Oceanologica Sinica, 2014, 36(12): 53-66. |
| [2] |
李新正. 我国海洋大型底栖生物多样性研究及展望:以黄海为例[J]. 生物多样性, 2011, 19(6): 676-684. LI X Z. An overview of studies on marine macrobenthic biodiversity from Chinese waters:Principally from the Yellow Sea[J]. Biodiversity Science, 2011, 19(6): 676-684. |
| [3] |
张莹, 吕振波, 徐宗法, 等. 环境污染对小清河口大型底栖动物多样性的影响[J]. 生态学杂志, 2012, 31(2): 381-387. ZHANG Y, LV Z B, XU Z F, et al. Impacts of environmental pollution on macrobenthos diversity in Xiaoqing estuary of Shandong Province, East China[J]. Chinese Journal of Ecology, 2012, 31(2): 381-387. |
| [4] |
贾树林, 王淑华, 田力, 等. 排污对锦州湾大型底栖动物生态的影响[J]. 海洋环境科学, 1982, 1(2): 79-87. JIA S L, WANG S H, TIAN L, et al. Effects of Wulihe River pollution outfall on the benthic communities of the Jinzhou Bay[J]. Marine Environmental Science, 1982, 1(2): 79-87. |
| [5] |
TABATABAIE T, AMIRI F. Evaluation of the impact of industrial sewage pollution on marine benthic communities[J]. Journal of Water supply:Research and Technology-Aqua, 2011, 60(6): 364-374. DOI:10.2166/aqua.2011.058 |
| [6] |
黄德铭, 刘晓收, 林明仙, 等. 污水排海对小型底栖生物丰度和生物量的影响[J]. 应用生态学报, 2014, 25(10): 3023-3031. HUANG D M, LIU X S, LIN M X, et al. Effects of sewage discharge on abundance and biomass of meiofauna[J]. Chinese Journal of Applied Ecology, 2014, 25(10): 3023-3031. |
| [7] |
朱延忠, 周娟, 林岿璇, 等. 基于MCI的厦门湾大型底栖动物群落健康状况评价[J]. 广西科学, 2015, 22(5): 549-557. ZHU Y Z, ZHOU J, LIN K X, et al. Assessment on the macrozoobenthos community health in Xiamen Bay using macrozoobenthos community index[J]. Guangxi Sciences, 2015, 22(5): 549-557. |
| [8] |
何明海, 蔡尔西, 吴启泉, 等. 厦门西港底栖生物的生态[J]. 台湾海峡, 1988, 7(2): 189-194. HE M H, CAI E X, WU Q Q, et al. Ecology of benthos in West Harbour of Xiamen[J]. Journal of Oceanography in Taiwan Strait, 1988, 7(2): 189-194. |
| [9] |
蔡文倩, 孟伟, 刘录三, 等. 渤海湾大型底栖动物群落优势种长期变化研究[J]. 环境科学学报, 2013, 33(8): 2332-2340. CAI W Q, MENG W, LIU L S, et al. Long-term trends of the dominant macrozoobenthos in Bohai Bay[J]. Acta Scientiae Circumstantiae, 2013, 33(8): 2332-2340. |
| [10] |
田胜艳, 张文亮, 张锐. 大型底栖动物在海洋生态系统中的作用[J]. 盐业与化工, 2009, 38(2): 50-54. TIAN S Y, ZHANG W L, ZHANG R. Role of macrobenthos in marine ecosystem[J]. Journal of Salt and Chemical Industry, 2009, 38(2): 50-54. |
| [11] |
CLARKE K R, GREEN R H. Statistical design and analysis for a 'biological effects' study[J]. Marine Ecology—Progress Series, 1988, 46: 213-226. DOI:10.3354/meps046213 |
| [12] |
田胜艳, 于子山, 刘晓收, 等. 丰度/生物量比较曲线法监测大型底栖动物群落受污染扰动的研究[J]. 海洋通报, 2006, 25(1): 92-96. TIAN S Y, YU Z S, LIU X S, et al. Abundance/biomass curves for detecting pollution effects on marine macrobenthic communities[J]. Marine Science Bulletin, 2006, 25(1): 92-96. |
| [13] |
王绪峨, 徐宗法, 周学家. 烟台近海底栖动物调查报告[J]. 生态学杂志, 1995, 14(1): 6-10. WANG X E, XU Z F, ZHOU X J. Benthic animal survey in Yantai inshores[J]. Chinese Journal of Ecology, 1995, 14(1): 6-10. |
| [14] |
张瑞安, 董以芝. 烟台排污海域的自然环境条件分析和污染物输运路径研究[J]. 海岸工程, 1990, 9(2): 35-44. ZHANG R A, DONG Y Z. Analysis of conditions of natural environment in sea areas for pollutant discharge and the study on pathways of pollutant transport in Yantai[J]. Coastal Engineering, 1990, 9(2): 35-44. |
| [15] |
刘瑞玉, 徐凤山. 黄、东海底栖动物区系的特点[J]. 海洋与湖沼, 1963, 5(4): 306-321. LIU R Y, XU F S. Preliminary studies on the benthic fauna of the Yellow Sea and the East China Sea[J]. Oceanologia et Limnologia Sinica, 1963, 5(4): 306-321. |
| [16] |
刘晓收, 史书杰, 周红, 等. 渤海大型底栖动物多样性及其与环境因子的关系[J]. 广西科学, 2015, 22(5): 540-548. LIU X S, SHI S J, ZHOU H, et al. Macrofaunal diversity and its relationship with environmental factors in Bohai Sea[J]. Guangxi Sciences, 2015, 22(5): 540-548. |
| [17] |
周然, 覃雪波, 彭士涛, 等. 渤海湾大型底栖动物调查及与环境因子的相关性[J]. 生态学报, 2014, 34(1): 50-58. ZHOU R, QIN X B, PENG S T, et al. Macroinvertebrate investigation and their relation to environmental factors in Bohai Bay[J]. Acta Ecologica Sinica, 2014, 34(1): 50-58. |
| [18] |
DIPPNER J W, IKAUNIECE A. Long-term zoob-enthos variability in the Gulf of Riga in relation to climate variability[J]. Journal of Marine Systems, 2001, 30(3/4): 155-164. |
| [19] |
吴耀泉, 张波. 烟台芝罘湾水域底栖动物生态环境特征[J]. 海洋环境科学, 1994, 13(3): 1-6. WU Y Q, ZHANG B. Ecological environment characteristics of macrobenthos in Yantai Zhifu Bay waters[J]. Marine Environmental Science, 1994, 13(3): 1-6. |
| [20] |
王全超, 李宝泉. 烟台近海大型底栖动物群落特征[J]. 海洋与湖沼, 2013, 44(6): 1667-1680. WANG Q C, LI B Q. Community structure of macrobenthos in coastal water off Yantai, East China[J]. Oceanologia et Limnologia Sinica, 2013, 44(6): 1667-1680. |
| [21] |
李晓静, 周政权, 陈琳琳, 等. 山东烟台大沽夹河河口及邻近海域大型底栖动物群落特征[J]. 生物多样性, 2016, 24(2): 157-165. LI X J, ZHOU Z Q, CHEN L L, et al. Characteristics of macrobenthic communities in the estuary of Dagujia River and its adjacent water areas in Yantai, Shandong[J]. Biodiversity Science, 2016, 24(2): 157-165. DOI:10.17520/biods.2015217 |
| [22] |
LI B Q, WANG Q C, LI B J. Assessing the benthic ecological status in the stressed coastal waters of Yantai, Yellow Sea, using AMBI and M-AMBI[J]. Marine Pollution Bulletin, 2013, 75(1/2): 53-61. |
| [23] |
周红, 华尔, 张志南. 秋季莱州湾及邻近海域大型底栖动物群落结构的研究[J]. 中国海洋大学学报, 2010, 40(8): 80-87. ZHOU H, HUA E, ZHANG Z N. Community sructure of macrobenthos in Laizhou Bay and adjacent waters[J]. Periodical of Ocean University of China, 2010, 40(8): 80-87. |
 2016, Vol. 23
2016, Vol. 23 


