2. 中国科学院大学,北京 100049;
3. 青岛海洋科学与技术国家实验室海洋生物学与生物技术功能实验室,山东青岛 266071
2. University of Chinese Academy of Sciences, Beijing, 100049, China;
3. Marine Biology and Biotechnology Laboratory, Qingdao National Laboratory for Marine Science and Technology, Qingdao, Shandong, 266071, China
【研究意义】南黄海位于中国大陆与朝鲜半岛之间,面积约为3.0×105 km2,平均深度为44 m,主要的水文特征包括中部的黄海冷水团、西部的苏北沿岸流、中东部的黄海暖流以及西南部的长江冲淡水,是许多经济鱼类、贝类和虾蟹类的重要产卵、索饵和育幼场。在过去的几十年中,受人类过度捕捞以及气候变化的影响,南黄海的许多资源物种遭到破坏,生物群落结构发生重大变化。大型底栖动物是海洋生态系统的重要组成部分,在海底有机质分解、食物网营养传递以及生物化学循环中起着重要作用[1-2]。由于大型底栖动物活动性相对较弱,种类组成比较稳定,海洋的群落生态研究在底栖动物方面进行较多。而在研究海洋生态系统时,常需要进行群落的划分来深入了解被研究区域的生物群落结构。因此,从大型底栖动物角度进行群落划分来探讨南黄海的群落结构变化,对于保护南黄海的生态系统健康具有重要意义。【前人研究进展】南黄海大型底栖动物生态调查始于20世纪50年代末的全国海洋普查,之后陆续有零星的调查研究,进入21世纪以来调查研究逐渐增多。刘瑞玉等[3]根据全国普查中的大型底栖生物资料使用Petersen-Thorson系统首次对南黄海的大型底栖生物进行群落划分,并以数量上或生物量上占优势的物种对各群落命名。其后南黄海群落划分多采用聚类分析的方法。Zhang等[4]根据1992年9月的大型底栖动物调查资料,使用基于Bray-Curtis相似矩阵的聚类分析(Cluster analysis, CLUSTER)方法,将南黄海的大型底栖动物群落主要划分为远海黄海冷水团群落,混合群落以及近岸广温性群落。李荣冠[5](根据1998—2000年的调查资料)、Zhang等[6](根据2007年6月的调查资料)、杨传平[7](根据2011—2012年的调查资料)等使用基于Bray-Curtis相似矩阵的聚类分析方法分别对南黄海的大型底栖生物进行了群落划分。【本研究切入点】由于以往调查资料的欠缺和数据处理方法的局限,目前南黄海大型底栖动物群落结构在不同调查月份间的变化尚未有报道。【拟解决的关键问题】根据2012年6月、8月和10月南黄海大型底栖动物的调查资料,使用基于Bray-Curtis相似矩阵的聚类分析(CLUSTER)、非参数多维标度排序(Non-metric multi-dimensional scaling, nMDS)、单因素相似性分析(One-way analysis of similarity, One-way ANOSIM)和相似性百分比分析(Similarity percentages, SIMPER)的方法,对南黄海大型底栖动物群落结构的月际变化进行探讨。
1 材料与方法 1.1 研究海域与站位分布于2012年6月、8月和10月搭载“北斗号”科学调查船在120.5°~124.0°E、33°~37°N之间的南黄海海域进行了3个航次的大型底栖动物定点调查。3个航次共设置站位26个(图 1),其中6月航次实际调查站位为18个,8月为21个,10月为23个。
|
图 1 南黄海大型底栖动物采样站位 Fig.1 Sampling sites of macrofauna in the South Yellow Sea |
使用0.1 m2的箱式采泥器采集沉积物样品,每站成功取样2次,使用底层0.5 mm网目的套筛现场分选大型底栖动物,将生物标本和残渣转移至样品瓶,用75%(V/V)酒精保存。在实验室中使用解剖镜进行大型底栖动物分类鉴定,计数并使用0.000 1g感量的电子天平称重(湿重,软体动物带壳称重)。样品的处理、保存、计数和称重均按照《海洋调查规范》(GB/T 12763.6-2007)[8]进行。
1.3 数据分析与处理大型底栖动物群落结构划分采用聚类分析(CLUSTER)和非参数多维标度排序(nMDS)实现[9]。聚类和排序分析之前使用丰度数据构建Bray-Curtis相似矩阵,数据经过二次方根转化。去除各航次出现频率小于5%的物种[10]或仅出现于一个站位的物种,以减少稀有种效应。采用单因素相似性分析(One-way ANOSIM)检验不同月份间以及同一月份不同群落间物种组成的差异显著性。应用相似性百分比(SIMPER)计算同一群落的平均相似性,并分析其主要贡献种[11]。
站位图和群落分布图使用Surfer 11.0软件绘制,群落结构分析使用PRIMER 5.0软件实现。
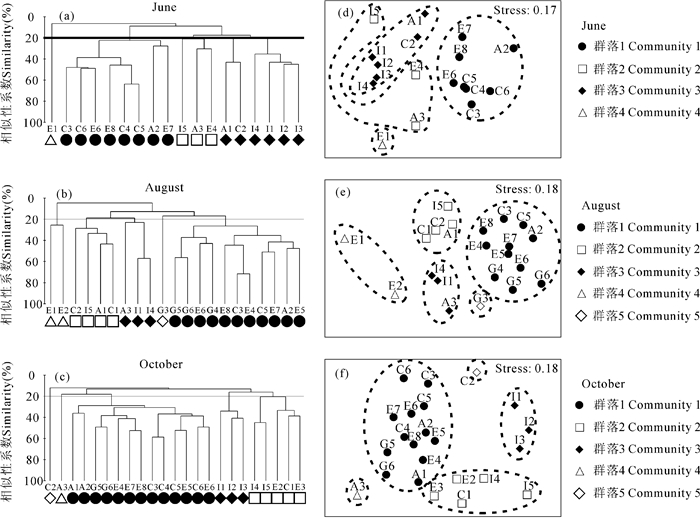
2 结果与分析 2.1 不同月份间的群落结构分析对6月、8月和10月3个月份的大型底栖动物分别进行聚类分析(CLUSTER)和非参数多维标度排序(nMDS),发现在20%的Bray-Curtis相似性水平上,南黄海大型底栖动物可以划分为4~5个群落(图 2)。单因素相似性分析(One-way ANOSIM)表明3个月份间群落结构差异显著(Global R=0.107,P=0.001 < 0.05);成对显著性检验结果显示6月、10月间以及8月、10月间群落结构差异显著(6/10:R=0.103,P=0.015 < 0.05;8/10:R=0.148,P=0.002 < 0.05),而6月、8月间差异不显著(6/8:R=0.058,P=0.071 > 0.05)。SIMPER分析表明各月份除了群落1的贡献种为棘皮动物和软体动物,其余群落的贡献种以多毛类动物居多(表 1)。
|
群落1=黄海冷水团群落,群落2=混合群落,群落3=广温性群落,群落4和5由于站位较少,未将其命名 Community 1=Yellow Sea Cold Water Mass community, Community 2=Mixed community, Community 3=Eurythermal community, Community 4 and 5 were not named for the low number of sites 图 2 南黄海大型底栖动物群落等级聚类图(a~c)和nMDS图(d~e) Fig.2 Clustering plots (a~c) and nMDS plots (d~e) of macrofaunal community in the South Yellow Sea |
| 表 1 南黄海主要大型底栖动物(贡献率>10%)的贡献率和累加贡献率 Table 1 Contribution and cumulative contribution of main macrofauna (contribution>10%) in the South Yellow Sea |
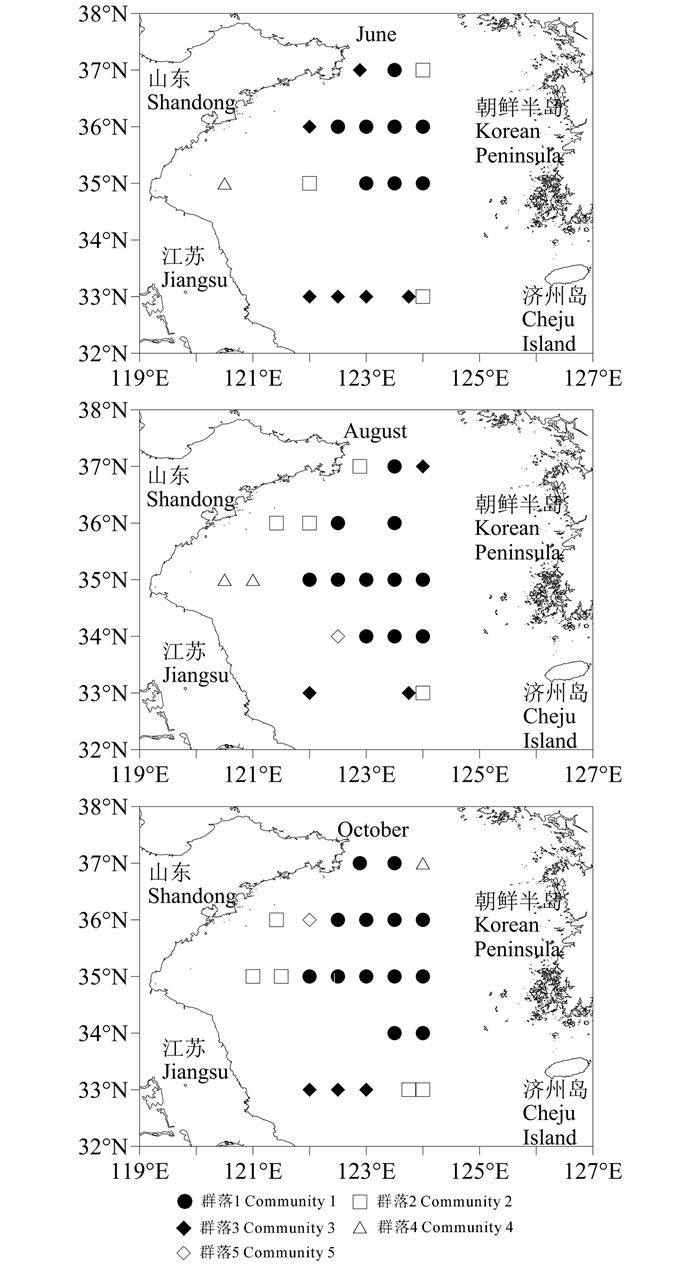
在20%的Bray-Curtis相似性水平上,6月大型底栖动物可划分为4个群落。群落1包括8个站位,全部位于黄海冷水团中心位置,该群落的大部分物种是冷水性物种,又称黄海冷水团群落。SIMPER分析表明该群落的平均相似性为30.38%,主要贡献种为浅水萨氏真蛇尾(Ophiura sarsii vadicola)和薄索足蛤(Thyasira tokunagai) (表 1、图 3)。群落2位于黄海冷水团边缘,包括3个站位,物种组成上冷水性和暖水性物种并存,又称混合群落。该群落的平均相似性为19.17%,主要贡献种包括日本角吻沙蚕(Goniada japonica)、掌鳃索沙蚕(Ninoe palmata)、拟节虫(Praxillellasp.)和巴氏钩毛虫(Sigambra bassi)。群落3由6个站位组成,位于南黄海西南部和北部近岸海域,多为暖水性物种,又称广温性群落。该群落的平均相似性为21.20%,贡献种主要为拟特须虫(Paralacydonia paradoxa)和掌鳃索沙蚕。群落4仅位于海州湾的E1站,其中丰度较高的物种为哈鳞虫(Harmothoe sp.),为10 ind./m2。ANOSIM分析表明各群落间物种组成差异显著(Global R=0.84,P=0.001 < 0.05)。
|
图 3 南黄海大型底栖动物群落分布 Fig.3 Distribution plots of macrofaunal community in the South Yellow Sea |
8月大型底栖动物在20%的Bray-Curtis相似性水平上划分为5个群落。群落1(黄海冷水团群落)包括11个站位,位于黄海冷水团中心位置,范围较6月广。SIMPER分析发现该群落的平均相似性为26.70%,主要贡献种为浅水萨氏真蛇尾、日本梯形蛤(Portlandia japonica)和角海蛹(Ophelina acuminata) (表 1、图 3)。群落2(混合群落)由4个站位组成,位于群落1的周围,平均相似性为26.14%,主要贡献种为角海蛹、掌鳃索沙蚕和背蚓虫(Notomastus latericeus)。群落3(广温性群落)包括3个站位,主要位于南黄海的南部,平均相似性为31.24%,主要贡献种包括掌鳃索沙蚕,索沙蚕(Lumbrineris sp.)和寡鳃齿吻沙蚕(Nephtys oligobranchia)。群落4包括位于海州湾的2个站位,平均相似性仅为6.84%,贡献种主要包括紫蛇尾(Ophiopholis mirabilis)、孟加拉海扇虫(Pherusa bengalensis)、东方缝栖蛤(Hiatella orientalis)以及锥唇吻沙蚕(Glycera onomichiensis)。群落5仅G3站,该站有大量的浅水萨氏真蛇尾和司氏盖蛇尾(Stegophiura sladeni)出现,丰度分别为60 ind./m2和20 ind./m2。ANOSIM分析表明群落间物种组成差异显著(Global R=0.85,P=0.001 < 0.05)。
2.4 10月群落划分10月大型底栖动物也可划分为5个群落。群落1(黄海冷水团群落)包括13个站位,位于南黄海中部,范围较6月和8月广。SIMPER分析表明该群落的平均相似性为29.88%,主要贡献种与6月相同,为浅水萨氏真蛇尾和薄索足蛤(表 1、图 3)。群落2(混合群落)由5个站位组成,位于黄海冷水团群落周围,平均相似性为22.69%,主要贡献种包括长叶索沙蚕(Lumbrineris longifolia)、日本角吻沙蚕、尖叶长手沙蚕(Magelona cincta)以及掌鳃索沙蚕。群落3(广温性群落)包括3个站位,位于南黄海西南部海域,平均相似性为28.70%,贡献种主要有拟特须虫(Paralacydonia paradoxa)、不倒翁虫(Sternaspis scutata)、长叶索沙蚕(Lumbrineris longifolia)以及足刺拟单指虫(Cossurella aciculata)。群落4和群落5均由1站构成,分别为A3和C2站。群落4丰度最高的物种为薄索足蛤(15 ind./m2),群落5为背蚓虫(40 ind./m2)。ANOSIM分析表明群落间物种组成的总体差异显著(Global R=0.79,P=0.001 < 0.05)。
3 讨论南黄海大型底栖动物在20%的相似性水平上,主要被划分为3个群落,从外海到近岸依次为黄海冷水团群落、混合群落和广温性群落[4]。本研究采用了与Zhang等[4]相同的数据处理方法,发现时隔20年后,南黄海的大型底栖动物仍可主要划分为上述3个群落。
黄海冷水团群落位于黄海中部,水温较低。该群落的物种为冷水性物种,其中浅水萨氏真蛇尾在6—10月均为该群落的最主要的贡献种,贡献率均在37%以上。而Zhang等[4]根据1992年9月的调查资料发现黄海冷水团群落最主要的贡献种为太平洋方甲涟虫(Eudorella pacifica),浅水萨氏真蛇尾贡献率排在第3位,为14.48%。刘瑞玉等[3]根据全国海洋普查资料使用Petersen-Thorson系统将黄海冷水团的大型底栖动物命名为薄索足蛤-蜈蚣欧努菲虫(Onuphis geophiliformis)-浅水萨氏真蛇尾群落,说明在20世纪50年代末该群落的最主要的优势种是薄索足蛤,浅水萨氏真蛇尾排在第3位。从20世纪50年代末到2012年,特别是近20年,浅水萨氏真蛇尾逐渐成为黄海冷水团群落最主要的大型底栖动物。从群落的空间分布来看,2012年6—10月黄海冷水团群落的空间分布范围逐渐向近岸扩张,其西侧边界从122.5°E扩张到122.0°E。相比1992年9月[4],在36°N断面,黄海冷水团群落的西边界从1992年9月的123.0°E向西扩张至2012年8月和10月的122.5°E,而在35°N断面,该群落的西边界从1992年9月的122.5°E向西扩张至2012年8月和10月的122.0°E。
混合群落位于黄海冷水团群落边缘,该位置水温较黄海冷水团高。混合群落的主要种类全部为多毛类动物。Zhang等[4]通过SIMPER分析也发现混合群落的贡献种大部分为多毛类动物,其他类群仅软体动物薄索足蛤1种。刘瑞玉等[3]描述了20世纪50年代末存在于黄海冷水团群落边缘的3个群落,从北往南分别是角管虫(Ditrupa arietina)-海蛹(Travisia pupa)群落,海鸡头(Chromonephthea sp.)群落以及钩倍棘蛇尾(Amphioplus ancistrotus)-褐管蛾螺(Siphonalia spadicea)群落,其空间位置与本研究中的混合群落较为吻合。3个群落的优势种包括多毛类动物、腔肠动物、棘皮动物和软体动物。对比本研究的结果发现,从20世纪50年代末到2012年,混合群落的优势类群向着多毛类动物呈单极化发展。这可能与人类活动对海洋的影响逐渐增强有关。例如,底层拖网捕鱼活动会同时将蛇尾类捕获,直接导致其死亡,或者破坏蛇尾类的腕,使其活动能力和捕食能力减弱从而间接导致其死亡[12-13]。
广温性群落主要位于南黄海西南部33°N断面,与Zhang等[4]的调查结果一致。该区域在20世纪50年代末主要有2个群落,即毛蚶(Anadara kagoshimensis)-织纹螺(Nassarius sp.)群落和哈氏刻肋海胆(Temnopleurus hardwickii) -日本倍棘蛇尾(Amphioplus japonicus)群落[3]。与历史研究相比较,广温性群落的优势类群也向着多毛类动物呈单极化发展,与混合群落的时间变化趋势较为相似。生命周期较短的多毛类动物能够适应由于人为活动导致的不稳定的生存环境,取代生命周期较长的其他物种而成为该群落的优势类群。这种现象在同样受人类活动影响的长江口海域也被发现[14]。
4 结论南黄海大型底栖动物群落结构的月份间差异显著。在20%的Bray-Curtis相似性水平上,南黄海大型底栖动物可以划分为4~5个群落,通过与历史资料对比,发现南黄海大型底栖动物群落在过去半个世纪发生了重大变化,但仍主要以黄海冷水团群落、混合群落和广温性群落为主。各群落在物种组成上存在显著差异。黄海冷水团群落最主要的优势类群由以前的软体动物和甲壳动物变为浅水萨氏真蛇尾,而混合群落和广温性群落的优势类群主要由过去的棘皮动物和软体动物变为多毛类动物。
致谢 王金宝、董栋、马林、寇琦、彭松耀、甘志彬、许鹏、黄慧、龚琳、王跃云等参加或部分参加了本研究的野外考察、实验室样品鉴定和处理、数据分析工作,在此致以衷心的感谢。| [1] |
GAUDÉNCIO M J, CABRAL H N. Trophic structure of macrobenthos in the Tagus estuary and adjacent coastal shelf[J]. Hydrobiologia, 2007, 587(1): 241-251. DOI:10.1007/s10750-007-0686-6 |
| [2] |
NORLING K, ROSENBERG R, HULTH S, et al. Importance of functional biodiversity and species-specific traits of benthic fauna for ecosystem functions in marine sediment[J]. Marine Ecology Progress Series, 2007, 332: 11-23. DOI:10.3354/meps332011 |
| [3] |
刘瑞玉, 崔玉珩, 徐凤山, 等. 黄海、东海底栖生物的生态特点[J]. 海洋科学集刊, 1986(27): 153-173. LIU R Y, CUI Y H, XU F S, et al. Ecological characteristics of macrobenthos of the Yellow Sea and the East China Sea[J]. Studia Marina Sinica, 1986(27): 153-173. |
| [4] |
ZHANG J L, XU F S, LIU R Y. Community structure changes of macrobenthos in the South Yellow Sea[J]. Chinese Journal of Oceanology and Limnology, 2012, 30(2): 248-255. DOI:10.1007/s00343-012-1076-0 |
| [5] |
李荣冠. 中国海陆架及邻近海域大型底栖生物[M]. 北京: 海洋出版社, 2003. LI R G. Macrobenthos on the Continental Shelves and Adjacent Waters, China Sea[M]. Beijing: Ocean Press, 2003. |
| [6] |
ZHANG J L, XIAO N, ZHANG S P, et al. A comparative study on the macrobenthic community over a half century in the Yellow Sea, China[J]. Journal of Oceanography, 2016, 72(2): 189-205. DOI:10.1007/s10872-015-0319-z |
| [7] |
杨传平.南黄海大型底栖动物生态学研究[D].青岛:中国海洋大学, 2014. YANG C P.The Ecological Study on Macrobenthos in the Southern Yellow Sea, China[D].Qingdao:Ocean University of China, 2014. http://cdmd.cnki.com.cn/article/cdmd-10423-1014368453.htm |
| [8] |
中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会.海洋调查规范第6部分:海洋生物调查:GB/T12763.6—2007[S].北京:中国标准出版社, 2008:1-159. General Administration of Quality Supervision, Inspection and Quarantine of the PRC, Standardization Administration of the PRC.Specifications for Oceanographic Survey-Part 6:Marine Biological Survey:GB/T12763.6—2007[S].Beijing:China Standard Press, 2008:1-159. http://www.oalib.com/references/19444307 |
| [9] |
周红, 张志南. 大型多元统计软件PRIMER的方法原理及其在底栖群落生态学中的应用[J]. 青岛海洋大学学报, 2003, 33(1): 58-64. ZHOU H, ZHANG Z N. Rationale of the multivariate statistical software PRIMER and its application in benthic community ecology[J]. Journal of Ocean University of Qingdao, 2003, 33(1): 58-64. |
| [10] |
ALMEIDA C, COELHO R, SILVA M, et al. Use of different intertidal habitats by faunal communities in a temperate coastal lagoon[J]. Estuarine Coastal and Shelf Science, 2008, 80(3): 357-364. DOI:10.1016/j.ecss.2008.08.017 |
| [11] |
LABRUNE C, GRÉMARE A, AMOUROUX J M, et al. Assessment of soft-bottom polychaete assemblages in the Gulf of Lions (NW Mediterranean) based on a mesoscale survey[J]. Estuarine Coastal and Shelf Science, 2007, 71(1/2): 133-147. |
| [12] |
BERGMANN M, BEARE D J, MOORE P G. Damage sustained by epibenthic invertebrates discarded in the Nephrops fishery of the Clyde Sea area, Scotland[J]. Journal of Sea Research, 2001, 45(2): 105-118. DOI:10.1016/S1385-1101(01)00053-3 |
| [13] |
PRENA J, SCHWINGHAMER P, ROWELL T W, et al. Experimental otter trawling on a sandy bottom ecosystem of the Grand Banks of Newfoundland:Analysis of trawl bycatch and effects on epifauna[J]. Marine Ecology Progress Series, 1999, 181: 107-124. DOI:10.3354/meps181107 |
| [14] |
SHOU L, ZENG J N, LIAO Y B, et al. Temporal and spatial variability of benthic macrofauna communities in the Yangtze River estuary and adjacent area[J]. Aquatic Ecosystem Health & Management, 2013, 16(1): 31-39. |
 2016, Vol. 23
2016, Vol. 23 


