【研究意义】浮游动物是鱼类的重要饵料,其摄食和排便在海洋生物地球化学循环中发挥着重要的作用[1-2]。在野外调查、实验研究和模型预测中,研究人员都将采集到的浮游动物视为活体,但实际上网采的浮游动物样品中存在一定数量的浮游动物死体,这导致对浮游动物生命周期的估计存在错误。相应的,与浮游动物生命周期相关的渔业模型、生态预测模型也会产生较大的误差[3]。可以说死体的存在对整个浮游动物生态功能和作用的理解造成了障碍。然而,由于长久以来没有简易的方法对死体进行区分,研究者对于海洋生态系统中浮游动物死体的规模和贡献知之甚少。【前人研究进展】浮游动物死体是指由非捕食性因素导致死亡的浮游动物个体(比如由于自身寿命、疾病、有毒赤潮、寄生、食物短缺等因素导致的死亡),其外形基本完好,用甲醛固定后无法与活体区分[4-5]。在显微观察过程中,研究者早就发现有些桡足类用解剖针触碰后没有反应,而其外形与其它活体并无差异,说明这就是桡足类的死体。而用解剖针触碰也成了最简单的区分桡足类死活的方法,并通过该方法发现海区中存在一定量的浮游动物死体,其范围从5%到90%不等[5],但是该方法只能在室内采用,无法处理大量的野外样品。1972年,Dressel等[6]通过中性红染色法对死体进行区分,并将其应用到野外调查中,但该方法染色时间长,对某些类群区分的准确率未知。之后从1974年到2006年,分别有多位研究人员对染色方法进行改进,但终究未能达到野外调查的要求[7-8]。直到2009年,Elliott和Tang[5]才将中性红染色法改进到适合野外应用的程度。此后,各地陆续开展这方面的调查,发现在调查区域浮游动物的死体均值为25%~33%(文献[9])。但相关调查在很多海区(如我国海域)尚未开展。因此,全球海洋中浮游动物死体的概况尚无法勾画。除了海洋中死体的规模,研究者还对死体产生的原因进行研究,发现船舶航行、气候变化和食物短缺都有可能是死体产生的原因[10]。以前倾向于认为,浮游动物的粪便和死亡后的残体是向底层输出有机碳的,而对死体的研究发现,有部分死体可能还来不及往下输出就已经在上层分解了[11-13]。这对于研究全球尺度的碳循环是一个有用的信息。【本研究切入点】虽然浮游动物的死体可能占有一定的比例,且其生态作用不容忽视,然而当今国内尚未开展这方面的研究工作。由于资金和人力的缺乏,本研究选择距离较近的钦州湾作为研究对象,以了解浮游动物死体在广西近海的可能规模及其对我们认识海洋生态系统的影响,为后来者提供参考。【拟解决的关键问题】于2015年冬季在钦州湾选择6个站位进行垂直拖网,采用中性红染色法区分浮游动物死体,研究冬季钦州湾浮游动物死体的组成、分布及其对丰度、优势度和多样性指数的影响。
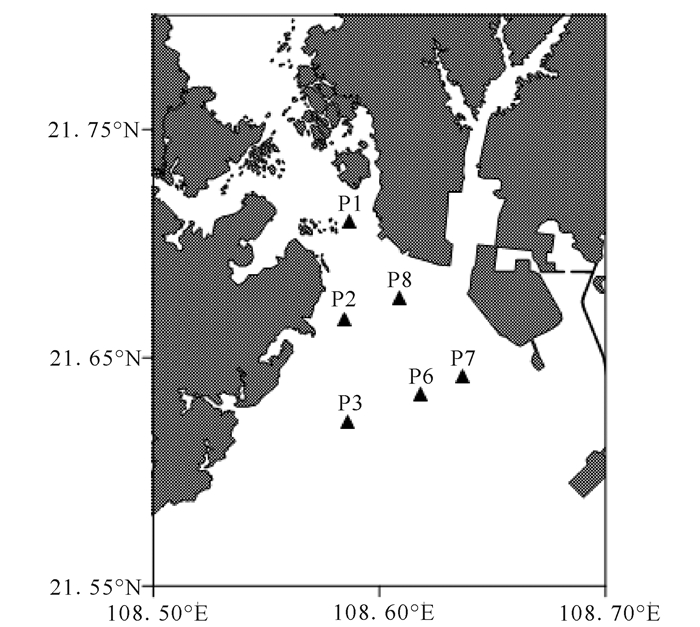
1 材料与方法 1.1 调查海区及采样方法于2015年12月29日在钦州湾选择6个站位分别进行垂直拖网(图 1),采集浮游动物。选择浅水Ⅱ型浮游生物网进行拖网(网孔单边长度160 μm),在垂直拖网前,用网具过滤10 L原位海水备用;在垂直拖网后,保持网口超出海面,来回缓慢拖拽,逐渐向上提起网具,以避免激烈冲洗造成的浮游动物死亡。
|
▲Stations 图 1 图 1采样站位 Fig.1 Location of sampling stations |
往2 L的广口瓶中加入500 mL前面过滤的原位海水,然后将收集到的浮游动物放广口瓶中,再次添加过滤的原位海水至1 L。添加中性红溶液(10 g/L)1.5 mL,黑暗条件下,甲板上流水培养15~20 min,筛绢过滤,反复洗涤,以去除过量的染料,洗涤干净后,把样品过滤收集到筛绢上,放入培养皿中,低温保存,带回实验室后,-20℃条件下保存。分析时以类似盐度大小的海水洗下,用HCl调pH值 < 7,倒置显微镜或者解剖镜下,暗视野观察,染色鲜红者为活体,无染色或染色粉红者为死体[5]。
1.3 丰度将样品洗下,定容至200 mL,摇匀,取10 mL在解剖镜下解剖鉴定,并计数各种类的丰度。浮游动物的丰度系死体与活体丰度相加之和。
1.4 优势度优势度按如下公式计算:
Y=Nif/N,
其中Y表示物种优势度,Ni为第i种个体数,N为该海域所有个体总数之和,f为该种出现的频率,当Y≥0.02时,将该种视为优势种[14]。
1.5 生物多样性生物多样性指数(H′)按如下公式计算:
| $ H' = - \sum\limits_{i = 1}^S {{P_i}{{\log }_2}{P_i}} . $ |
其中H′为生物多样性指数,Pi为第i种个数与总数量的比值,S为物种数。
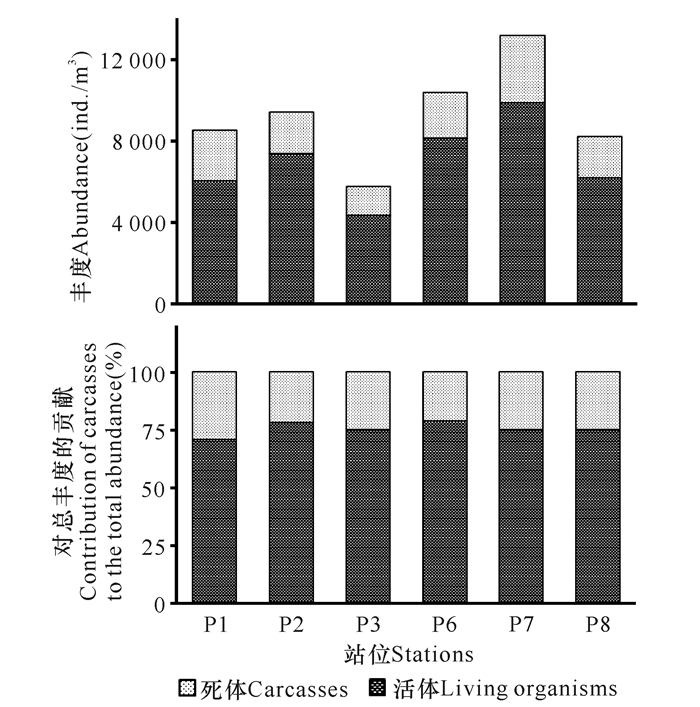
2 结果与分析 2.1 死体对浮游动物丰度的贡献由图 2可知,调查期间6个站位浮游动物的丰度为4 315~9 864个/m3,平均(6 970±1 921)个/m3。而死体的丰度为(1 429~3 286)个/m3,平均(2 252±616)个/m3。死体占浮游动物丰度的21.4%~29.4%,平均值(24.5±2.9)%,除P1站位死体所占比例稍大外,其余各站位死体在浮游动物丰度中的贡献基本类似。总体而言,浮游动物丰度大的地方,死体的量也相应较大,但其所占比例基本类似。
|
图 2 各站位中死体对浮游动物总丰度的贡献 Fig.2 The contribution of carcasses to the total abundance of zooplankton in different stations |
调查期间共鉴定浮游动物31种(类),其中出现死体的有15种(类),占种类数的48.4%,具体出现死体的种(类)见表 2。在已发现死体的种(类)中,死体出现的比例从小拟哲水蚤的(4.5±3.0)%到长腕幼虫的100%不等,发现死体的种(类)中,死体所占的平均比例为(38.8±25.4)%。在有出现死体的15种(类)中,一旦在某一站位发现其活体,则在该站位同时发现其死体的概率占100%的有11种(类),平均概率为(82.2±31.0)%(表 2)。
| 表 2 不同种(类)浮游动物中死体所占的比例及其出现的概率 Table 2 The proportion and appearance probability of carcasses in specific zooplankton |
以优势度≥0.02为依据确定优势种(类),在未考虑死体影响的情况下优势种(类)为10种,去除死体后进行计算,发现优势种(类)有9种,具体名录见表 3。结合表 2结果,发现所有优势种中除针刺拟水蚤外,均发现死体。而且优势种中除强额孔雀水蚤外,其它优势种(类)一旦在某站位发现活体,则其死体出现的概率为100%。曼足类无节幼体在不考虑死体影响的情况下是优势种(类),而去除死体的情况下则不再是优势类群。
| 表 3 死体的存在对优势种(类)的影响 Table 3 Effects of carcasses on the dominant species |
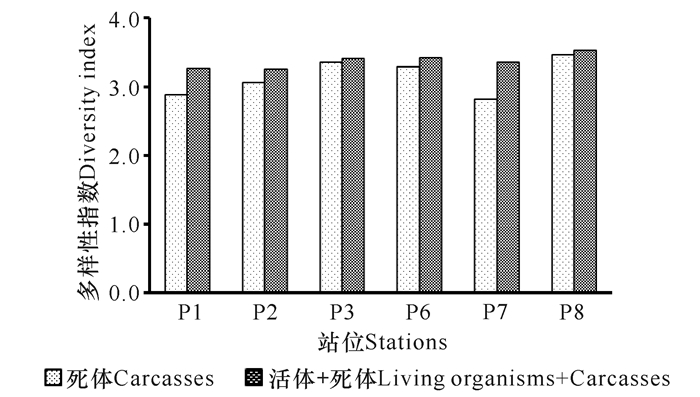
浮游动物的多样性指数是对海洋生态系统进行评价的重要指标,在去除死体情况下,所有站位的多样性指数均降低,各站位降低1.6%~15.9%,平均降低(6.9±5.7)%(图 3)。其中降低最多的是P7站(15.9%),其次是P1站(11.7%)。在未扣除死体的影响前,各站位的多样性指数差异不大,为3.3~3.5,平均值3.4±0.1。而去除死体后各站多样性指数为2.8~3.5,平均值3.1±0.3;说明扣除死体后,各站的多样性指数差异变大(图 3)。
|
图 3 死体的存在对多样性指数的影响 Fig.3 Effects of the carcasses on the diversity index (Shannon-Weaver index) |
根据以前的调查,钦州湾存在大量小型桡足类(拟哲水蚤属),这些类群如果用Ⅰ型网(网孔单边长度505 μm)采集,则大部分会在拖网过程中漏掉[15]。为避免该类群的死体在采样过程中漏掉,本研究选择用Ⅱ型网进行样品采集。
此外,要获得准确的结果,在拖网时候要尽量避免冲水洗网,造成人为致死。在条件允许的情况下,最好是进行两次拖网:第一次拖网不进行染色,按常规方法进行,用水冲洗,收集样品,以保证总丰度的准确性;第二次拖网进行染色,避免冲洗,直接收集样品。第一次拖网样品计数总丰度,第二次拖网样品则分别计算各种(类)死体和活体所占的比例,然后将第二次拖网所获得的比例与第一次拖网的结果相乘,即可得到更为准确的结果。由于船时有限,本研究未进行两次拖网,但通过在海表面反复拖拽的方式进行洗网,也可减少洗网致死所造成的误差。
3.2 染色方法当前对浮游动物死体的染色方法有两种,一种是适用于海水的中性红染色法,另外一种是适用于淡水的苯胺蓝染色法,在近岸河口区这样的特殊区域一般多选用中性红染色法。这两种方法都是从桡足类的研究中发展起来,对甲壳动物及其幼体有很好的鉴别力,同时对住囊虫属和其它浮游动物幼体的染色效果也很好[5, 16]。该方法发表于2009年,尚未应用于所有海区及所有种类,且由于各海区环境条件差异大,浮游动物群落组成也不一样,因此,在使用前应先了解海区的浮游动物类群,如包含有未报道种类,需要先做预实验,以确定染色效果。因为有报道称中性红对不同的浮游动物种类其染色效果并不一样,而且即便是同样的种类,在不同环境条件下,其染色效果也不尽相同,特别需要注意在河口区和极地低温条件下的使用[17]。冬季钦州湾的浮游动物种类中,除羽腕幼虫和长腕幼虫未见报道外,在前人的研究报道中其它种类均有良好的染色效果。根据我们以前的调查,羽腕幼虫和长腕幼虫均未被染色,但2015年夏天在钦州湾进行的预实验中,这两个类群既有被染色的个体又有没有被染色的个体,因此有理由认为本研究中的羽腕幼虫和长腕幼虫均是死体。
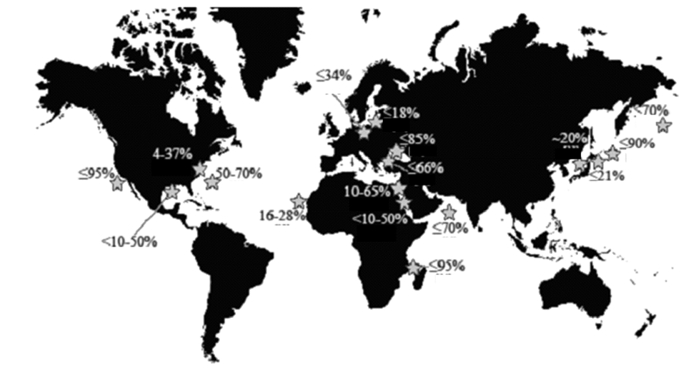
3.3 死体在浮游动物中所占的比例不同海区浮游动物中死体所占的比例不尽相同,甚至差异巨大,但其平均值大约为25%~33%(图 4)[4-5]。我们的调查显示,在冬季的钦州湾死体对总丰度的贡献为21.4%~29.4%,平均值24.5%(图 2),在其它研究所报道的范围内(图 4)。要准确计算死体的生物量并不容易,从解剖镜下一个个分选耗时耗力。我们选择对所有样品进行称量,计算湿重,然后将丰度比例直接转换成湿重比率的方法,粗略计算得到冬季钦州湾浮游动物的死体湿重为122~298 mg/m3,平均值为197 mg/m3。虽然这样的处理方法存在很大误差,不能用于严谨的研究,但可提供一个相对直观的认识,以帮助我们了解浮游动物死体在生态系统中的比重,引起研究者的注意。
|
图 4 世界各海区浮游动物死体占浮游动物丰度的比例[4] Fig.4 The contribution of carcasses to the total abundance of zooplankton in the world oceans[4] |
不同种类的浮游动物,其死体的贡献是不一样的。本研究发现除针刺拟水蚤外,所有优势种(类)中均发现死体。而且优势种(类)中除强额孔雀水蚤外,其它优势种(类)一旦在某站位发现活体,则其死体出现的概率为100%(表 2)。也就是说,最能体现浮游动物对浮游植物控制力的优势种群中有超过1/4的类群是死体,而且这不是个别站位的情况,是所有站位均如此。这虽然不会影响用稀释法计算的浮游动物对浮游植物的摄食率,但会明显低估用食物减少法计算的单个浮游动物的摄食率。而且这样大数量的死体的存在,让我们不得不重新审视水华发生时反应滞后的浮游动物真实的时间持续性问题。
3.4 浮游动物死体的存在对环境评价的影响优势种的确定和多样性指数的计算是海洋生态环境评价中常用的指标,是我们认识海洋生态系统健康程度的重要工具。本研究发现扣除死体前后对优势度的影响不大。仅曼足类幼体在去除死体后优势度降低,不能算做优势种群(表 3),这主要是由于P7站的曼足类幼体全部是死体导致的。至于为何P7站的曼足类幼体均是死体,由于缺乏其它资料,尚无法解释,有待进一步研究。死体的存在会导致浮游动物活体丰度的错估,以往的研究多将死体数直接计入总丰度,所以必然会导致多样性指数的高估。本研究发现去除死体的影响后各站位多样性指数降低1.6%~15.9%,平均降低了(6.9±5.7)%(图 3),这样的降低在大部分站位影响不大,但在P1(11.7%)和P7(15.9%)站则影响相对较大。因此,在研究群落多样性时,应特别注意特殊区域死体的影响。比如在水华发生区域,水华消退后,可能的食物短缺会造成浮游动物大量死亡,而这些死体会导致错估该区域的物种多样性。
4 结论冬季钦州湾浮游动物的死体约占总丰度的1/4,基本上在所有的优势种(类)中均发现死体,除个别种(类)外,一旦在某站位发现优势种(类)的活体,则该站位相应的优势种(类)死体出现的概率为100%。浮游动物死体的存在会误导我们对优势种和多样性的认识,主要是对多样性的高估。
| [1] |
唐启升, 苏纪兰, 孙松, 等. 中国近海生态系统动力学研究进展[J]. 地球科学进展, 2005, 20(12): 1288-1299. TANG Q S, SU J L, SUN S, et al. A study of marine ecosystem dynamics in the coastal ocean of China[J]. Advances in Earth Science, 2005, 20(12): 1288-1299. |
| [2] |
BEAUGRAND G, REID P C, IBAÑEZ F, et al. Reorganization of North Atlantic marine copepod biodiversity and climate[J]. Science, 2002, 296(5573): 1692-1694. DOI:10.1126/science.1071329 |
| [3] |
ELLIOTT D T, TANG K W. Influence of carcass abundance on estimates of mortality and assessment of population dynamics in Acartia tonsa[J]. Marine Ecology Progress Series, 2011, 427: 1-12. DOI:10.3354/meps09063 |
| [4] |
TANG K W, ELLIOTT D T.Copepod carcasses:Occurrence, fate and ecological importance[M]//SEURONT L(ed.).Copepods:Diversity, Habitat and Behaviour.New York:Nova Science Publishers, 2014:255-278.
|
| [5] |
ELLIOTT D T, TANG K W. Simple staining method for differentiating live and dead marine zooplankton in field samples[J]. Limnology and Oceanography Methods, 2009, 7(8): 585-594. DOI:10.4319/lom.2009.7.585 |
| [6] |
DRESSEL D M, HEINLE D R, GROTE M C. Vital staining to sort dead and live copepods[J]. Chesapeake Science, 1972, 13(2): 156-159. DOI:10.2307/1351022 |
| [7] |
FLEMING J M, COUGHLAN J. Preservation of vitally stained zooplankton for live/dead sorting[J]. Estuari-es and Coasts, 1978, 1(2): 135-137. DOI:10.2307/1351607 |
| [8] |
TANG K W, FREUND C S, SCHWEITZER C L. Oc-currence of copepod carcasses in the lower Chesapeake Bay and their decomposition by ambient microbes[J]. Estuarine Coastal and Shelf Science, 2006, 68(3/4): 499-508. |
| [9] |
ELLIOTT D T, HARRIS C K, TANG K W. Dead in the water:The fate of copepod carcasses in the York River estuary, Virginia[J]. Limnology and Oceanography, 2010, 55(5): 1821-1834. DOI:10.4319/lo.2010.55.5.1821 |
| [10] |
BICKEL S L, HAMMOND J D M, TANG K W. Boat-generated turbulence as a potential source of mortality among copepods[J]. Journal of Experimental Marine Biology and Ecology, 2011, 401(1/2): 105-109. |
| [11] |
GLUD R N, GROSSART H P, LARSEN M, et al. Copepod carcasses as microbial hot spots for pelagic denitrification[J]. Limnology and Oceanography, 2015, 60(6): 2026-2036. DOI:10.1002/lno.10149 |
| [12] |
BICKEL S L, TANG K W. Microbial decomposition of proteins and lipids in copepod versus rotifer carcasses[J]. Marine Biology, 2010, 157(7): 1613-1624. DOI:10.1007/s00227-010-1434-4 |
| [13] |
TANG K W, HUTALLE K M, GROSSART H P. Microbial abundance, composition and enzymatic activity during decomposition of copepod carcasses[J]. Aquatic Microbial Ecology, 2006, 45(3): 219-227. |
| [14] |
徐兆礼, 陈亚瞿. 东黄海秋季浮游动物优势种聚集强度与鲐鲹渔场的关系[J]. 生态学杂志, 1989, 8(4): 13-15. XU Z L, CHEN Y Q. Aggregated intensity of dominant species of zooplankton in autumn in the East China Sea and Yellow Sea[J]. Journal of Ecology, 1989, 8(4): 13-15. |
| [15] |
王荣, 张鸿雁, 王克, 等. 小型桡足类在海洋生态系统中的功能作用[J]. 海洋与湖沼, 2002, 33(5): 453-460. WANG R, ZHANG H Y, WANG K, et al. Function performed by small copepods in marine ecosystem[J]. Oceanologia et Limnologia Sinica, 2002, 33(5): 453-460. |
| [16] |
BICKEL S L, TANG K W, GROSSART H P. Use of aniline blue to distinguish live and dead crustacean zooplankton composition in freshwaters[J]. Freshwater Biology, 2009, 54: 971-981. DOI:10.1111/fwb.2009.54.issue-5 |
| [17] |
ÕMORI M, IKEDA T. Methods in Marine Zooplankton Ecology[M]. New York: Wiley-Liss, 1984: 332.
|
 2016, Vol. 23
2016, Vol. 23 

